
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO 、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25 ℃时各组分含量随pH变化情况如图所示(Cl-) 没有画出。则下列分析不正确的是
、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25 ℃时各组分含量随pH变化情况如图所示(Cl-) 没有画出。则下列分析不正确的是

A.亚氯酸钠在酸性条件下较稳定
B.25 ℃时,HClO2的电离平衡常数的数值Ka=10-6
C.使用该漂白剂的最佳pH范围为4--5
D.25 ℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(忽略ClO2和Cl-),则混合溶液中有c(HClO2)+2c(H+)=c(ClO )+2c(OH-)
)+2c(OH-)
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:2017届山东省潍坊市临朐县高三12月阶段测化学试卷(解析版) 题型:实验题
碱式碳酸钴[ Cox(OH)y(CO3)2 ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示进行实验。
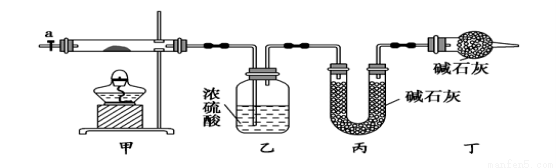
⑴请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中___________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
⑵步骤④中缓缓通入空气数分钟的目的是_________ _________。
_________。
⑶某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_____ _(填字母)连接在_____ ____(填装置连接位置)。
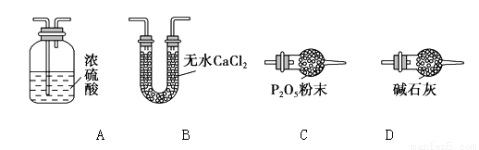
⑷若按正确装置进行实验,测得如下数据:
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为____________________。
⑸CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等 杂质)制取CoCl2·6H2O的一种工艺如下:
杂质)制取CoCl2·6H2O的一种工艺如下:
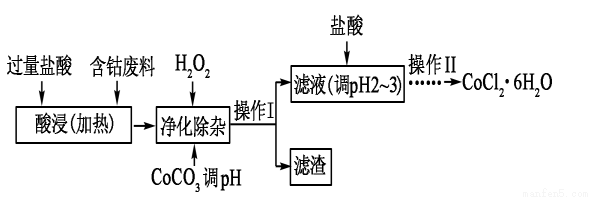
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为__________________。
③加盐酸调整PH为2~3的目的为____________________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期末化学试卷(解析版) 题型:填空题
合成氨工业是工农业生产和国防工业的基础产业,也是国民经济的命脉产业。其原理如下:N2(g)+3H2(g)?2NH3(g)△H〈 0 。
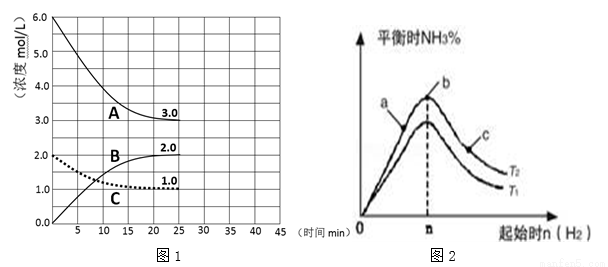
(1)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如图1所示。
① 表示H2浓度变化的曲线是 (填序号)。
② 前25min 内,用NH3浓度变化表示的化学反应速率是 。
(2)某学习小组研究:在其他条件不变的情况下,研究改变起始物氢气的物质的量对该合成氨反应的影响.实验结果如图2所示:(图中T表示温度,n表示物质的量)
①比较T1 T2 (填“>”,“<”, “=”)。
②比较在a、b、c三点N2的转化率最高的是 ;H2的百分含量最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时(用含n的代数式表示),反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则在T2条件下,该反应的平衡常数K= 。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期末化学试卷(解析版) 题型:选择题
下列叙述正确的是 ( )
A.在熔融状态下,1molNa2O2完全电离出的离子数目为4 NA
B.常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1 NA
C. 0.1 mol·L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
D.0.1 mol MnO2与足量的浓盐酸加热反应生成Cl2的体积约为2.24 L
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:推断题
【化学——选修3:物质结构与性质】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为__________________。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为_________________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为___________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1 539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应过程中的离子方程式
为________________________;________________________。
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;

若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶胞的体积为________ cm3 (用代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:选择题
有关化学资源的合成、利用与开发的叙述合理的是
A.大量使用化肥和农药,能不断提高农作物产量
B.通过有机合成,可以制造出比钢铁更强韧的新型材料
C.安装煤炭燃烧过程中的“固硫”装置,主要是为了提高煤的利用率
D.开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高一上模拟考试化学卷(解析版) 题型:实验题
实验室使用Na2CO3·10H2O配制460mL0.100mol/LNa2CO3溶液,回答下列问题。
(1)现有下列仪器:烧杯、药匙、玻璃棒、托盘天平,配制时,还缺少的仪器是 。
(2)需称量Na2CO3·10H2O的质量为 。
(3)若加蒸馏水不慎超过刻度线,处理的方法是 。
(4)若实验遇下列情况,溶液的浓度偏高的是 。
A.溶解后没有冷却便进行定容 |
B.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀 |
C.定容时俯视容量瓶的刻度线 |
D.容量瓶内壁附有水珠而未干燥处理 |
F.称取的Na2CO3·10H2O晶体失去了部分结晶水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高一上模拟考试化学卷(解析版) 题型:选择题
实验室保存下列物质的方法中,不正确的是
A. 少量金属钠保存在煤油里
B. 烧碱溶液盛装在带玻璃塞的磨口玻璃瓶中
C. 新制氯水通常保存在棕色试剂瓶中
D. FeSO4溶液存放在加有少量铁粉的试剂瓶中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上模拟考试化学卷(解析版) 题型:选择题
环境污染问题越来越受到人们的关注,造成环境污染的主要原因是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——CO2 B.光化学污染——NO2
C.酸雨——SO2 D.臭氧层破坏——CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com