
分析 A.滴定时,眼睛应始终注视锥形瓶内液体颜色变化;
B.滴定实验不一定都需要指示剂;
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗,否则会导致测定值偏大;
D.用pH试纸测量某溶液的pH时不能先将试纸润湿,否则有偏差;
E.滴定管经蒸馏水洗净后,直接注入标准液,会导致标准液浓度偏低;
F.泛pH试纸测定值为整数;
G.滴定终点附近间隔要小些.
解答 解:A.酸碱中和滴定实验中,滴定时眼睛注视锥形瓶中溶液的颜色变化,以便及时判断滴定终点,不需要观察滴定管内液面的变化,故A错误;
B.KMnO4本身为紫红色,则用KMnO4滴定亚硫酸钠溶液的实验到达终点时,将出现红色,所以不需要另外加入指示剂,故B错误;
C.锥形瓶用蒸馏水洗净后,又用待测溶液润洗,增大待测液中的溶质的物质的量,消耗标准液体积增大,测定结果偏大,故C正确;
D.用pH试纸测量某溶液的pH时将试纸润湿,则溶液被稀释,影响测定结果,故D错误;
E.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定,标准液浓度降低,消耗标准液体积增大,测定结果偏大,故E正确;
F.泛pH试纸测定值为整数,所以读数不可能是小数,故F错误;
G.滴定终点附近间隔要小些,否则可能产生较大误差,故G错误;
故选CE.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断、实验操作及实验评价能力,明确实验原理、实验操作方法是解本题关键,易错选项是B.


科目:高中化学 来源: 题型:解答题
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能使溶液的pH增大 | |
| B. | 都能使溶液中c(H+)•c(CH3COO-)减小 | |
| C. | 都能使溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大 | |
| D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
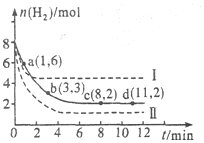 工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.
工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅在高温下 | B. | 在任何温度下都不能自发进行 | ||
| C. | 在任何温度下 | D. | 仅在低温下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com