
【题目】腈纶织物广泛地用作衣物、床上用品等。腈纶是由CH2=CH-CN聚合而成的,CH2=CH-CN可以由下列反应制得:□CH3-CH=CH2+□NH3+□O2→□CH2=CH-CN+□H2O
丙烯可以由石脑油裂解制得:C10H22→2C3H6+X
(1)配平方程式:□CH3-CH=CH2+□NH3+□O2→□CH2=CH-CN+□H2O
(2)写出上述反应式中X的同分异构体的结构简式 ;
(3)生物质含有葡萄糖、淀粉和纤维素等糖类,也称碳水化合物,绿色植物将二氧化碳和水变成碳水化合物,写出由二氧化碳和水变成葡萄糖的化学方程式 ;
(4)葡萄糖在碱性、加热条件下,能与 (试剂名称)反应析出光亮的金属;在加热条件下,也可与新制的氢氧化铜反应,写出该反应现象 。
【答案】(1)2CH3-CH=CH2+2NH3+3O2→2CH2=CH-CN+6H2O (2)![]()
![]() (3)
(3)![]()
(4)银氨溶液 产生砖红色沉淀
【解析】
试题分析:(1)反应中氧元素的化合价从0价降低到-2价,得到2个电子,甲基中碳元素的化合价从-3价升高到+3价,失去6个电子,则根据电子得失守恒可知反应的方程式为2CH3-CH=CH2+2NH3+3O2→2CH2=CH-CN+6H2O
(2)根据方程式C10H22→2C3H6+X和原子守恒可知X的分子式为C4H10,满足条件的同分异构体的结构简式为CH3CH2CH2CH3和CH(CH3)3;
(3)二氧化碳和水变成葡萄糖的化学方程式为![]() ;
;
(4)葡萄糖在碱性、加热条件下,能与银氨溶液反应析出光亮的金属;在加热条件下,也可与新制的氢氧化铜反应生成砖红色沉淀氧化亚铜。


科目:高中化学 来源: 题型:
【题目】下列说法中一定正确的是( )
A.Na2O2固体中阳离子与阴离子的个数比为1∶1
B.从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中
C.将Na投入饱和Na2CO3溶液中,会导致溶液质量增加
D.金属Na失火,可用CO2灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,2SO2+O2![]() 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是( )
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时, 18O在所有物质中都存在
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某混合物的无色透明溶液,可能含有以下离子中的若干种:
Na+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
①第一份加入足量AgNO3溶液有沉淀产生,加足量稀硝酸后沉淀部分溶解;
②第二份加足量NaOH溶液充分加热后,收集到气体0.896L(标准状况);
③第三份加足量BaCl2溶液后,过滤后充分干燥得到沉淀6.27g,再经足量稀硝酸洗涤、干燥后,沉淀质量变为2.33g。根据上述实验现象和有关数据,回答下列问题:
(1)原溶液中一定存在的阴离子是 ,一定不存在的离子是 ,可能存在的离子是 。
(2)②中发生化学反应的离子方程式为 。
(3)③中生成可溶于稀硝酸的沉淀化学式为 ,物质的量为 mol,该沉淀溶于稀硝酸的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C主要存在于蔬菜、水果中,它能增加人体对疾病的抵抗能力。
其结构简式为:
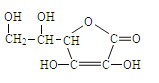
请回答:
(1)维生素C的分子式是 。
(2)维生素C可发生的化学反应有 (填序号)。
① 加成反应 ② 氧化反应 ③ 酯化反应
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为手性碳原子。具有手性碳原子的有机物具有光学活性。下列分子中,没有光学活性的是 ,含有两个手性碳原子的是 。
A.乳酸 CH3—CHOH—COOH
B.甘油 CH2OH—CHOH—CH2OH
C.脱氧核糖 CH2OH—CHOH—CHOH—CH2—CHO
D.核糖 CH2OH—CHOH—CHOH—CHOH—CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:
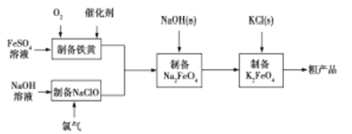
回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式 。
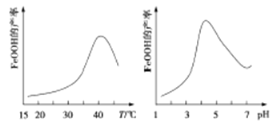
(2)制备铁黄的反应中氧化剂与还原剂的物质的量之比为 。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择 ;pH大于4.5时铁黄产率降低的主要原因可能是 。
(3)用高铁酸钾处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3、CN-等,生成的氢氧化铁胶体粒子还能吸附水中悬浮杂质。试写出高铁酸钾处理含CN-废水时除去CN-的离子方程式 。
(4)K2FeO4可作锌铁碱性高能电池的正极材料,电池反应原理:
2K2FeO4+3Zn+8H2O![]() 2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
(5)已知:常温下,Kap[Fe(OH)3]=4.0×10-38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)= mol·L-1。
(6)如果上述流程中,铁元素总利用率为75%。利用1mol 2mol·L-1FeSO4溶液能制备纯度为90%的高铁酸钾 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂。已知NH4ClO4在400℃时开始分解。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量)。
(1)甲同学设计如图实验(部分夹持装置已省略):
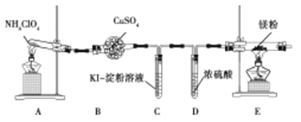
①若高氯酸铵分解有氯气生成,则可能观察到的现象是 ,写出产生该现象的离子方程式 。
②实验完毕后,取出E中硬质玻璃管中固体于试管中,滴加蒸馏水,产生的气体R能使红色湿润的石蕊试纸变蓝色。R的电子式为 。硬质玻璃管中固体与水反应放出R的化学方程式为 。
(2)乙同学认为,A中可能产生O2。为了验证他的猜想,选择上述部分装置和下列提供的装置进行实验:
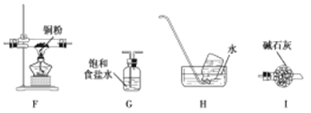
①按气流从左至右,装置的连接顺序为 。
②能说明有氧气的现象是 。
(3)通过查阅资料:NH4ClO4在℃时的分解产物为N2、Cl2、O2、H2O,写出高氯酸铵分解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
元素A、B、C、D、E、F、G在元素周期表中的位置如下图所示,回答下列问题:

(1)G的基态原子核外电子排布式为________。原子的第一电离能:D________E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l > l-b > b-b(l为孤对电子对,b为键合电子对),则关于A2C中的A-C-A键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于________晶体,该物质中存在的化学键类型有________,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为________。
(4)化合物BCF2的立体构型为________,其中B原子的杂化轨道类型是________,写出两个与BCF2具有相同空间构型的含氧酸根离子________。
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。每个晶胞中含有___________个E2+,列式计算EC晶体的密度(g·cm-3)______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物中一个碳原子上连有两个羟基时,易脱水形成碳氧双键;物质A~F有如下转化关系:

试回答下列问题:
(1)E中含有的官能团的名称是________,C跟新制的氢氧化铜悬浊液反应的化学方程式为________。
(2)A与NaOH溶液共热时反应的化学方程式为________。
(3)已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为________。
(4)F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应。若F苯环上的一氯代物只有两种,F在一定条件下发生加聚反应的化学方程式为________。
(5)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。则G可能有________种结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com