
【题目】已知![]() 氨基酸在一定条件下能与亚硝酸
氨基酸在一定条件下能与亚硝酸![]() 反应得到
反应得到![]() 羟基酸,如下:
羟基酸,如下:
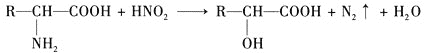
试根据如图所示关系回答下列有关问题。
(1)写出A、B的结构简式:A_________;B_________。
(2)![]() 的化学方程式为________。
的化学方程式为________。
(3)![]() 的化学方程式为________。
的化学方程式为________。
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:
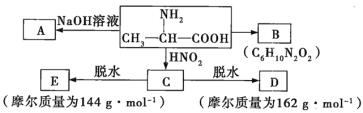
【题目】某氨基酸中含C、N、H、O四种元素,已知除氢原子外,其他原子均达到最外层8电子的稳定结构。如图为该氨基酸分子的球棍模型:

(1)氨基酸是_________(填“淀粉”“纤维素”“蛋白质”或“油脂”)完全水解的产物,该氨基酸的结构简式为__________。
(2)该氨基酸中含氧官能团的名称是____________。
(3)在浓硫酸、加热的条件下,该氨基酸与乙醇发生酯化反应的化学方程式为______。
(4)互为同系物的有机物具有相同的官能团,与该氨基酸互为同系物且少一个碳原子的氨基酸的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某线型高分子化合物的结构简式如图所示:
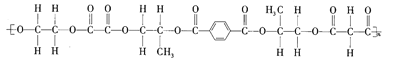
下列有关说法正确的是( )
A.该高分子化合物是由4种单体缩聚而成的
B.形成该高分子化合物的几种羧酸单体互为同系物
C.形成该高分子化合物的单体中的乙二醇可被![]() 催化氧化生成草酸
催化氧化生成草酸
D.该高分子化合物有固定的熔沸点,1mol该高分子化合物完全水解需要氢氧化钠的物质的量为5nmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子的最外层电子数是其内层电子数的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且元素Y的基态原子核外p电子比s电子多5个。
(1)Z的基态原子的核外电子排布式为____________________。
(2)Z的氧化物是石油化工中重要的催化剂之一,可催化异丙苯裂化生成苯和丙烯
①1 mol丙烯分子中含有![]() 键与
键与![]() 键数目之比为__________________。
键数目之比为__________________。
②苯分子中碳原子的杂化类型为_________________。
③Z的一种氧化物ZO5中,Z的化合价为+6,则其中过氧键的数目为______________。
(3)W、X、Y三种元素的电负性由小到大的顺序为_________________(用元素符号表示)。
(4)ZY3的熔点为1152℃,其在熔融状态下能够导电,据此可判断ZY3晶体属于____________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图所示。若该化合物的相对分子质量为M,晶胞边长为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_________ g/cm3。
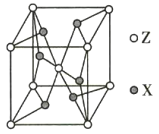
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)油酸的化学式为![]() ,其结构中含有
,其结构中含有![]() 、和
、和![]() 两种官能团,则通过实验检验
两种官能团,则通过实验检验![]() 的方法是__________;通过实验检验
的方法是__________;通过实验检验![]() 的方法是______。
的方法是______。
(2)![]() 某种油脂发生氢化反应,需标准状况下氢气的体积为
某种油脂发生氢化反应,需标准状况下氢气的体积为![]() ;等物质的量的该油脂氢化后,再发生皂化反应共消耗
;等物质的量的该油脂氢化后,再发生皂化反应共消耗![]() 。若该油脂是简单甘油酯,则它的结构可表示为______。
。若该油脂是简单甘油酯,则它的结构可表示为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了在锂离子电池领域 作出贡献的三位科学家。他们于 1972年提出“摇椅式“电池 ( Rock ing chair battery), 1980年开发出 LiCoO2材料, 下图是该电池工作原理图,在充放电过程中, Li+在两极之间“摇来摇去”,该电池充电时的总反应为:LiCoO2+ 6C ( 石墨)=Li (1-x)CoO2+LixC6。下列有关说法正确的是
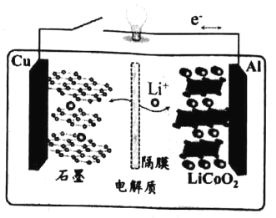
A.充电时,Cu 电极为阳极
B.充电时,Li+将嵌入石墨电极
C.放电时,Al 电极发生氧化反应
D.放电时,负极反应 LiCoO 2—xe-=Li (1-x)CoO2+ (1-x ) + xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量 SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备碳酸锰和硝酸铜晶体的主要工艺流程如图所示 :

已知:①部分金属阳离子生成氢氧化物沉淀的 pH范围如下表所示(开始沉淀的pH 按金属离子浓度为 0. l mol/L 计算)
开始沉淀的 pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
②100.8≈6.3
(1)酸浸时,下列措施能够提高浸取速率的措施是__________________ 。
A.将矿石粉碎 B.适当延长酸浸时间 C.适当升高温度
(2)酸浸时, MnO2 与Cu2S反应的离子方程式是 __________________。
(3)浸出液调节pH = 4 的目的是_____________________ ,浸出液中铜离子浓度最大不能超过_______________ molL-1(保留一位小数)。
(4)生成 MnCO3 沉淀的离子方程式是_______________________。
(5)本工艺中可循环使用的物质是 ___________________(写化学式)。
(6)流程中需要加入过量HNO3溶液,除了使 Cu2(OH)2CO3完全溶解外,另一作用是蒸发结晶时_______________________。
(7)制得的Cu(NO3)2 晶体需要进一步纯化, 其实验操作名称是______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂辉石是我国重要的锂资源之一,其主要成分为 Li2O、SiO2、Al2O3 以及含有少量 Na+、Fe2+、Fe3+、Ca2+、Mg2+等金属离子。工业上用锂辉石制备金属锂的工艺流程如下:
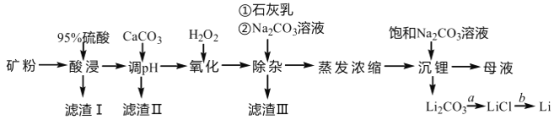
已知:①部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
沉淀物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Ca(OH)2 | Mg(OH)2 |
完全沉淀的pH | 5.2 | 9.6 | 3.2 | 13.1 | 10.9 |
②常温下,Ksp(Li2CO3)= 2.0×10-3。Li2CO3 在水中溶解度随着温度升高而减小。
③有水存在时,LiCl 受热可发生水解。
回答下列问题:
(1)为提高“酸浸”速率,上述流程中采取的措施有_____。
(2)滤渣 I 的主要成分是_____。滤渣 II 的主要成分是 Fe(OH)3、Al(OH)3。“氧化” 和“除杂”步骤主要除去的离子有_________。
(3) “沉锂”过程中发生反应的离子方程式是_____。用热水洗涤 Li2CO3 固体,而不用冷水洗涤,其原因是_____。
(4)设计简单的实验方案实现由过程 a 制取固体 LiCl:_____。
(5)工业上实现过程 b 常用的方法是_____。
(6)Li 可用于制备重要还原剂四氢铝锂(LiAlH4)。在有机合成中,还原剂的还原能力常用“有效氢”表示,其含义为 1克还原剂相当于多少克 H2 的还原能力。LiAlH4 的“ 有效氢”为_____(保留 2 位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①存在阳离子的物质中一定存在阴离子
②金属元素原子和非金属元素原子之间一定形成离子键
③离子键的实质是阳离子、阴离子间的相互吸引
④根据电离方程式![]() ,可判断HCl分子中存在离子键
,可判断HCl分子中存在离子键
⑤某些离子化合物中含有共价键
A.仅①②⑤B.仅③C.仅③④D.仅⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com