
向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是
A.氯化亚铁溶液中加入双氧水 B.硫酸亚铁酸性溶液中滴加硝酸钾溶液
C.硫酸铜溶液中滴加硝酸钡溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:实验题
氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域.其制备反应原理为:Al2O3+N2+3C═2AlN+3CO.制备过程中,原料配比不当或反应不完全等因素都会造成产品中含有碳或Al2O3等杂质.为测定产品中AlN的质量分数,某同学按如图1装置进行相关实验.可选用的化学试剂为:mg氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精.回答下列问题:
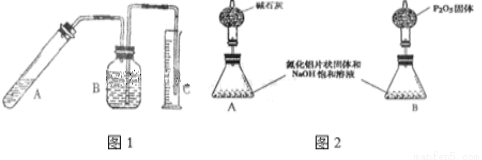
(1)组装完实验装置,使用前第一步应该
(2)图1(B)中试剂最好选用 (填序号):
①煤油 ② 医用酒精 ③水
医用酒精 ③水
已知A 中有NaAlO2生成,并放出有刺激性气味气体,写出A中发生反应的离子方程式 .
(3)读取C(量筒)中液体体积时,应注意下列问题,错误的是 (填序号)
a.C中液面不再上升时立即读数
b.上下移动C,使之液面与B中液面相平
c.A中不再有气泡逸出
d.视线与凹液面最低处相平
(4)mg氮化铝与足量NaOH饱和溶液反应,实验结束后,C中收集到液体的体积为VL(已折算成标准状况),则AlN样品的纯度为 (写计算表达式).
(5)上述实验方案,可能因气体体积测量不准,导致误差较大.有人建议改用下列A、B两个装置中的一种(在通风橱内进行),只需进行简单而又必要的数据测写,用差量法就可比较准确确定样品中AlN的质量分数.较合理的装置是: (填代号).
查看答案和解析>>
科目:高中化学 来源:2017届山东省栖霞市高三上学期期中化学试卷(解析版) 题型:选择题
化学与社会、生产、生活密切相关。下列说法不正确的是
A.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量
C.臭氧是氧化性极强的淡蓝色气体,可用作自来水的消毒剂
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代普 通DNA链中的P元素
查看答案和解析>>
科目:高中化学 来源:2017届山东省临沂市高三上学期期中化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1L pH=l的硫酸溶液中含有的H+数目为0.2NA
1L pH=l的硫酸溶液中含有的H+数目为0.2NA
B.1 mol羟基与l mol氢氧根离子所含质子数均为9NA
C. 14 g由N2与CO组成的混合气体中含有的原子数 目为2NA
目为2NA
D.标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月月考化学试卷(解析版) 题型:实验题
工业上利用含镍废料(镍铁钙镁合金为主)制取草酸镍(NiC2O4﹒H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐难溶于水。根据下列工艺流程示意图回答问题。
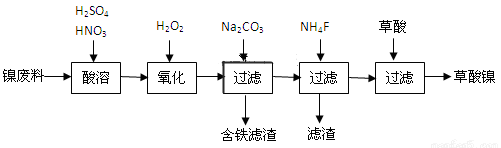
(1)Fe在元素周期表中的位置 _______________________________
(2)生产过程中多次进行过滤,玻璃棒在过滤操作中的一个作用是引流,下列实验操作中玻璃棒起引流作用的是 (填选项字母)
A.测定Na2CO3溶液的PH 
B.配制0.1mol/L 的H2SO4溶液
C.加热NaCl溶液制备NaCl晶体
D.验证Ba(OH)2 · 8H2O与NH4Cl固体反应吸热
(3)①加入H2O2发生的主要反应的离子方程式为_______________________
②加入NH4F后除掉的杂质是_____________________
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得三氧化二镍,同时获得混合气体。无水草酸镍受热分解的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列各组离子或分子能 大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是 ( )
大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是 ( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O |
B | Mg2+、Cl-、HCO3- | 过量NaOH溶液 | Mg2++2OH-=Mg(OH)2↓ |
C | K+、NH3•H2O,CO32-、 | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省宁德市高二上期中化学试卷(解析版) 题型:填空题
氨对地球上的生物相当重要,它是许多食物和肥料的重要成分。氨也是制造硝酸、化肥、炸药 的重要原料。氨在国民经济中占有重要地位。回答下列问题:
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______________。
②若起始时向容器内放入1 mol N2和3 mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为____________;若在同体积的容器中充人2 mol N2和6 molH2,达平衡后放出的热量为Q2 kJ,则Q2__________(填“>”、“<”或“=”)2Q1。
③已知:

1 mol N-H键断裂吸收的能量约等于__________kJ。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2 (g) 2NH3 (g),其平衡常数K与温度T的关系如下表:
2NH3 (g),其平衡常数K与温度T的关系如下表:

①平衡常数表达式K=_________,K1___________(填“>”、“<”或“一”)K2。
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是__________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1: 3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2 mol、1 mol、2 mol时,则此时该反应_________(填“处于”或“不处于”)平衡状态。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省宁德市高二上期中化学试卷(解析版) 题型:选择题
金属锡的冶炼常用焦炭作还原剂:SnO2+2C=Sn+2CO↑,反应过程中能量的变化如图所示。下列有关该反应的△H、△S的说法中正确的是( )
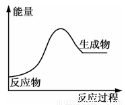
A.△H<0,△S<0 B.△H>0,△S<0
C.△H>0,△S>0 D.△H<0,△S>0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期中理化学试卷(解析版) 题型:填空题
已知2SO2(g)+O2 (g)
(g) 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。

请回答下列问题:
(1) 图中A点表示: ;图中C点表示: ;
图中A点表示: ;图中C点表示: ;
(2)写出 SO3(g)分解成SO2(g)和O2(g)的热化学方程式 ;
(3)能量E在一定条件下可以降低,这种条件是: ;
(4)SO3溶于水可生成H2SO4 ,化学方程式为 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com