
【题目】氨气可以做喷泉实验,这是利用氨气( )
A. 易液化 B. 比空气轻 C. 极易溶于水 D. 能跟水反应
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】(1)氨气极易溶于水,氨气与水反应的化学方程式为____________________;氨水显碱性的原因是_____________________________(用离子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(![]() )增大的是____(填字母,下同)。
)增大的是____(填字母,下同)。
②能使c(OH-)增大、c(![]() )减少的是____。
)减少的是____。
③能使c(OH-)和c(![]() )都增大的是____。
)都增大的是____。
④能使c(OH-)和c(![]() )都减少的是____。
)都减少的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氧化铝不能与水反应,它不是氢氧化铝对应的氧化物
B. 因为氧化铝是金属氧化物,所以它是碱性氧化物
C. 氧化铝能跟所有的酸碱溶液反应
D. 氧化铝能跟强的酸碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )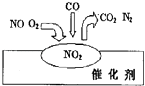
A.NO2是该过程的最终产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeBr2溶液中通入标准状况下的Cl2 3.36L,Cl2全部被还原,最终测得溶液中c(Br﹣)是c(Cl﹣ )的一半,则原FeBr2溶液的物质的量浓度(molL﹣1)是( )
A.0.75
B.1.5
C.2
D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学防护对预防病毒感染非常重要,下列说法错误的是
A.冠状病毒粒子直径约60-220 nm,介于溶液和胶体粒子之间
B.制作防护服和口罩的无纺布是有机高分子材料
C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
D.二氧化氯泡腾片可用于水处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象.请帮助该同学整理并完成实验报告.
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
(1)实验目的:研究同周期元素性质递变规律.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
实验内容 | ① | ② | ③ | ④ |
实验现象(填A~D) |
(3)写出实验①和④对应化学方程式 实验① ,
实验④ .
(4)实验结论: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com