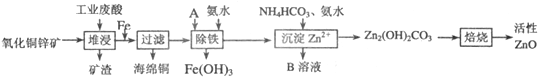
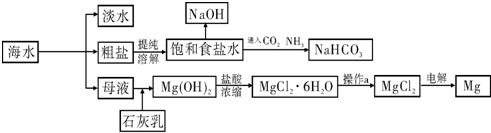
【化学--选修化学与技术】
在工厂中常使用煤作燃料,但煤燃烧后会产生有害的SO
2,按“循环经济”的模式,就是要将SO
2收集起来,把它变为有用的东西.
(1)向大气中过量排放SO
2将会形成酸雨污染.正常雨水的pH约为
5.6
5.6
.
(2)三氧化硫通入浓氨水,可得到一种肥料,写出反应的化学的方程式:
SO3+2NH3?H2O=(NH4)2SO4+H2O
SO3+2NH3?H2O=(NH4)2SO4+H2O
(3)某空气监测是根据SO
2和溴水的定量反应来测定SO
2的含量.该反应的化学方程式为
SO2+Br2+2H2O=2H2SO4+2HBr
SO2+Br2+2H2O=2H2SO4+2HBr
.反应后溶液的pH
变小
变小
(填“变大”、“变小”或“不变”).若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×10
18个电子转移,则SO
2的含量为
0.64
0.64
mg?L
-1,若规定空气中SO
2含量不得超过0.02mg?L
-1,则样气是否符合大气的质量标准
不符合
不符合
(填“符合”或“不符合”).
(4)近闻美国和日本正在研究用Na
2SO
3吸收法作为治理SO
2污染的一种新方法:
第一步是用Na
2SO
3水溶液吸收SO
2;
第二步是加热吸收液,使之重新生成Na
2SO
3,同时得到含高浓度SO
2水蒸气副产品,写出上述两步反应的化学方程式:
①
Na2SO3+SO2+H2O=2NaHSO3
Na2SO3+SO2+H2O=2NaHSO3
.
②
.



 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O