
【题目】设![]() 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
A.![]() 与
与![]() 组成的混合物中,含有的电子数目为
组成的混合物中,含有的电子数目为![]()
B.![]() (标准状况)
(标准状况)![]() 与足量乙烷反应时,断裂的
与足量乙烷反应时,断裂的![]() 键数目为
键数目为![]()
C.![]() 浓度均为
浓度均为![]() 的
的![]() 、
、![]() 溶液中,
溶液中,![]() 数目前者比后者多
数目前者比后者多![]()
D.![]() [电离方程式:
[电离方程式:![]() ]消耗
]消耗![]() 数目最多为
数目最多为![]()
【答案】C
【解析】
A. C60与C50均是由碳原子组成的,3.6 g碳原子的物质的量n(C)=![]() =0.3 mol,每个C原子中含有6个电子,则0.3 mol C原子中含有电子数目:0.3 mol ×6NA/mol=1.8NA,选项A正确;
=0.3 mol,每个C原子中含有6个电子,则0.3 mol C原子中含有电子数目:0.3 mol ×6NA/mol=1.8NA,选项A正确;
B. 6.72L(标准状况)Cl2的物质的量n(Cl2)=![]() =0.3 mol,Cl2与足量的乙烷反应时,有一半的氯原子取代烷烃分子中的氢原子,故反应时断裂的C-H键物质的量为0.3 mol,选项B正确;
=0.3 mol,Cl2与足量的乙烷反应时,有一半的氯原子取代烷烃分子中的氢原子,故反应时断裂的C-H键物质的量为0.3 mol,选项B正确;
C. 0.1 L浓度为2 mol/L盐溶液中含有溶质的物质的量为n=2 mol/L×0.1 L=0.2 mol,若不考虑盐的水解,NH4+数目前者比后者多0.2NA,但NH4+能水解且水解程度与溶液中c(NH4+)有关,离子浓度越小,水解程度越大,故两种溶液中NH4+数目:前者比后者多的数值大于0.2NA,选项C错误;
D. 由硼酸电离方程式可知:硼酸为一元酸,所以0.1 mol H3BO3消耗OH-数目最多为0.1 NA,选项D正确;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)写出H2C2O4溶液和酸性KMnO4溶液反应的离子方程式___________;
(2)探究温度对化学反应速率影响的实验编号是_____(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____;
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率υ(KMnO4)=_____mol/(L·min);
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.6gSiO2晶体中含有的硅氧键数目为0.2NA
B.常温下pH=12的Na2CO3溶液中,由水电离出OH-的数目为0.01NA
C.常温常压下,10gD2O含有的质子数、电子数、中子数均为5NA
D.将含0.01molFeCl3的饱和溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是 ( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某烷烃的相对分子质量为72。回答下列问题:
(1)写出该烷烃的分子式__。
(2)写出其同分异构体的结构简式__。
(3)若此烷烃的一氯代物分子中有三个—CH3,一个—CH2—,其结构简式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。下列说法错误的是
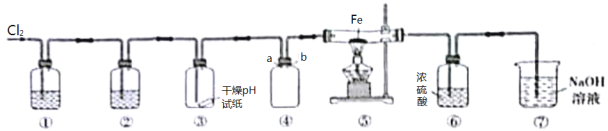
A.④中a导管应向下延伸至接近瓶底
B.若撤去⑥,则⑤中可能有Fe2O3生成
C.当⑤中充满黄绿色气体时再点燃⑤处酒精灯
D.③中试纸若是湿润的,则根据产生的现象可证明氯气有酸性,漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是
A.![]() 晶体硅含
晶体硅含![]() 键的数目为
键的数目为![]() ,则
,则![]() 金刚砂含
金刚砂含![]() 键的数目也为
键的数目也为![]()
B.![]() 溶液中加入过量的
溶液中加入过量的![]() 溶液,发生化学反应的方程式:
溶液,发生化学反应的方程式:![]() ,则
,则![]() 溶液中加入过量的
溶液中加入过量的![]() 溶液,发生化学反应的方程式:
溶液,发生化学反应的方程式:![]()
C.标准状况下,![]() 中所含的分子数目为
中所含的分子数目为![]() 个,则
个,则![]() 中所含的分子数目也为
中所含的分子数目也为![]() 个
个
D.![]() 溶液中通入过量
溶液中通入过量![]() 发生了反应:
发生了反应:![]() ,则
,则![]() 溶液中通入过量
溶液中通入过量![]() 发生了:
发生了:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com