
【题目】叠氮化钠(NaN3)是白色六方系晶体,剧毒,易溶于水,是HN3(氢叠氮酸,酸性与醋酸相似的弱酸)的钠盐。回答下列问题:
(1)实验室可用NaN3分解(生成两种单质)制备高纯N2,已知NA为阿伏加德罗常数的值,每生成1 mol N2转移电子数为___________。
(2)NaN3和稀硫酸反应制HN3的离子方程式为______________。
(3)NaNH2与N2O在210~220℃时反应可制备NaN3,同时放出能使湿润红色石蕊试纸变蓝的气体,该反应的化学方程式为_____________________。
(4)测定工业品叠氮化钠中NaN3质量分数的实验步骤如下:
(I)准确称量试样m g,另加少许NaOH于烧杯中,加入适量蒸馏水溶解,转移至250mL容量瓶中定容;
(II)准确移取配得的溶液20.00mL于锥形瓶中,慢慢加入V1 mL c1 mol·L-1(NH4)2Ce(NO3)6溶液,充分反应后,加适量水稀释,加入5 mL浓硫酸,加2滴邻罗啉指示剂,用c2 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定到溶液由淡绿色变为黄红色(Ce4++Fe2+=Ce3++Fe3+),消耗标准溶液V2 mL。
①NaN3与(NH4)2Ce(NO3)6溶液反应的氧化产物为N2,还原产物为Ce(NO3)3,其离子方程式为______。
②则样品中NaN3的质量分数为__________(列出计算表达式)。
【答案】![]() N3-+H+=HN3 2NaNH2+N2O=NaN3+ NaOH+NH3 2N3-+2Ce4+
N3-+H+=HN3 2NaNH2+N2O=NaN3+ NaOH+NH3 2N3-+2Ce4+![]() 3N2↑+2Ce3+
3N2↑+2Ce3+ 
【解析】
(1) 2NaN3=2Na+3N2,由反应式可得出关系式3N2——2e-,从而可计算出生成1 mol N2转移的电子数。
(2)书写NaN3和稀硫酸反应制HN3的离子方程式时,NaN3能拆成离子形式,因为它是一种可溶性盐。
(3)从氧化还原分析,NaNH2+N2O=NaN3+H2O,但产物中还有NH3生成,则还需再加入NaNH2,认为它跟H2O反应,从而生成NaOH和NH3,把两个反应合二为一,即可得出该反应的化学方程式。
(4) ①在整个过程中,发生以下反应:
2N3-+2Ce4+=3N2+2Ce3+,Ce4++Fe2+=Ce3++Fe3+。
②通过第二个离子方程式,可求出过量的Ce4+的物质的量,利用总量与过量的Ce4+的差值,求出与N3-反应的Ce4+的物质的量,从而求出N3-的物质的量,最后求出样品中NaN3的质量分数。
(1) 2NaN3=2Na+3N2,由反应式可得出关系式3N2——2e-,现在N2为1 mol,则转移的电子数![]() 。答案为:
。答案为:![]() ;
;
(2)NaN3和稀硫酸反应制HN3的离子方程式为N3-+H+=HN3。答案为:N3-+H+=HN3;
(3)从氧化还原分析,NaNH2+N2O=NaN3+H2O,但产物中还有NH3生成,则另一反应为NaNH2+H2O=NaOH+NH3,从而得出该反应的化学方程式2NaNH2+N2O=NaN3+ NaOH+NH3。答案为:2NaNH2+N2O=NaN3+ NaOH+NH3;
(4) ①在整个过程中,发生以下反应:
2N3-+2Ce4+![]() 3N2↑+2Ce3+,Ce4++Fe2+=Ce3++Fe3+。
3N2↑+2Ce3+,Ce4++Fe2+=Ce3++Fe3+。
①NaN3与(NH4)2Ce(NO3)6溶液反应的氧化产物为N2,还原产物为Ce(NO3)3,其离子方程式为2N3-+2Ce4+![]() 3N2↑+2Ce3+;答案为:2N3-+2Ce4+
3N2↑+2Ce3+;答案为:2N3-+2Ce4+![]() 3N2↑+2Ce3+;
3N2↑+2Ce3+;
②20.00mL溶液中,N3-的物质的量为:(c1V1-c2V2)×10-3mol,
样品中NaN3的质量分数为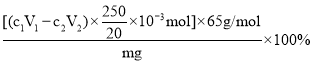
= 。答案为:
。答案为: 。
。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①![]() O、
O、![]() O、
O、![]() O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥
O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥![]() K、
K、![]() Ca、
Ca、![]() Ar,回答下列问题:
Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)![]() H2
H2![]() O的摩尔质量为____________,相同质量的
O的摩尔质量为____________,相同质量的![]() H2
H2![]() O与
O与![]() H2
H2![]() O所含质子数之比为______,中子数之比为__________。
O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的![]() H2
H2![]() O和
O和![]() H2
H2![]() O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() gNa和
gNa和![]() gAl同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为
gAl同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为![]() 下列说法正确的是
下列说法正确的是![]()
A.反应中放出的气体在标准状况下的体积为![]()
B.参加反应的水的质量与加入Al的质量相等
C.所得溶液中![]() 和
和![]() 的物质的量之比为2:1
的物质的量之比为2:1
D.所得溶液中阳离子和阴离子的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质.从铝土矿中提取氧化铝的流程如图所示:
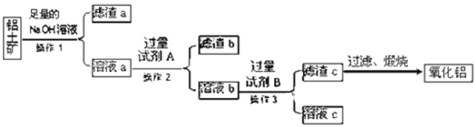
(1)操作1的名称是______,所需要的主要玻璃仪器有:______.
(2)试剂A是______;(用化学式回答).
(3)溶液b与试剂B反应的离子方程式为______________________.
(4)请写出铝土矿加入足量NaOH溶液所发生的有关反应化学方程式:______________,
(5)某同学认为可以向溶液a中通入的是过量的CO2,然后直接将得到的滤渣b煅烧后也可得到Al2O3,而且可以简化上述提取氧化铝的流程.你认为该同学的看法合理吗?______(填“合理”或“不合理”)理由是:______.(若认为合理该问题可以不回答)
(6)电解熔融的氧化铝可制备金属铝:2Al2O3![]() 4Al+3O2↑.若在标准状况下生成2.24L的氧气,则该反应转移的电子数为______.
4Al+3O2↑.若在标准状况下生成2.24L的氧气,则该反应转移的电子数为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
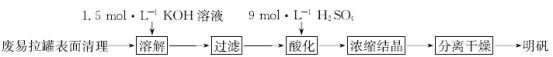
【题目】用废易拉罐制备明矾的实验步骤如下:
回答下列问题:
(1)清除已剪成片状的废易拉罐表面颜料及塑料内膜的方法是_________________。
(2)实验需用100 mL 1.5 mol·L-1 KOH溶液,配制时需称取KOH固体质量为_________;配制过程中需要的玻璃仪器有烧杯、量筒、玻璃棒及_____________和_____________。
(3)“溶解”时发生反应的化学方程式为________________。
(4)“酸化”时,为使硫酸滴加量不过量太多,正确的操作依据是_________。
(5)鉴定明矾中含有K+的操作方法及现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是
A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生D.该体系中,Ksp(CaF2)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.标准状况下,22.4L己烷含有的共价键总数为19NA
B.1L 0.1 mol·L-1 Na2CO3溶液中阴阳离子数之和为0.3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.密闭容器中l.5mol H2与0.5mol N2充分反应,得到NH3的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
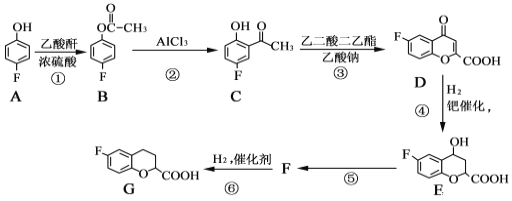
奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是_________________;B中所含官能团的名称是____________。
(2)反应⑤的化学方程式为____________________________,反应①的反应类型是_______________。
(3)D 的分子式为_____________。
(4)写出满足下列条件的E的同分异构体的结构简式:_________ 、________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备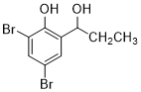 的合成路线流程图(无机试剂任选)___________________合成路线流程图示:CH3CH2Br
的合成路线流程图(无机试剂任选)___________________合成路线流程图示:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,关于该有机物的说法不正确的是
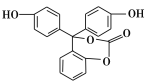
A.该有机物的化学式为C20H14O5
B.该有机物可发生加成、取代、氧化、消去等反应
C.该有机物分子中的三个苯环不可能共平面
D.1 mol该有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com