
下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合: 2AlO |
|
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
如图中的曲线表示在一定条件下 ,2NO+O2
,2NO+O2 2NO2△H<0,反应中NO的转化率与温度的关系。图中标出a、b、 c、 d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
2NO2△H<0,反应中NO的转化率与温度的关系。图中标出a、b、 c、 d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
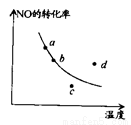
A. a点
B. b点
C. c点
D. d点
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:选择题
将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入6mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是
A.当金属全部溶解时收集到NO气体的体积为3.36L
B.当生成沉淀达到最大量时,消耗NaOH溶液的体积为V≥75ml
C.参加反应的金属的总质量一定是9.9g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.45mol
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数,下列叙述正确的是
A.2 L1mol/L的醋酸溶液中所含氢离子数为2 NA
B.1molFe与过量的稀HNO3反应,转移的电子数为2 NA
C.标准状况下分子数为NA的CO、C2H4混合气体所占体积约为22.4 L,质量为28 g
D.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三上学期期中化学试卷(解析版) 题型:填空题
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途。
Ⅰ.工业上有多种方法来制备氮化硅,下面是几种常见的方法:
(1)方法一 直接氮化法:在1300~1400 ℃时,高纯粉状硅与纯氮气化合,其反应方程式为3Si+2N2 Si3N4
Si3N4
(2)方法二 可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜,其反应方程式为___________________。
(3) 方法三 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是___________________。
方法三 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是___________________。
(4)方法四 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体__________________(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为_________________。
Ⅱ.工业上制取高纯硅和四氯化硅的生产流程如下:

已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)写出焦炭与原料B中的主要成分反应的化学方程式:__________________
(2)上述生产流程中电解A的水溶液时,以Cu为阳极电解A的水溶液电解反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三上学期期中化学试卷(解析版) 题型:选择题
研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2硫酸有下列变化:
①潮湿的氯气通过盛有浓H2SO4的洗气瓶
②硫化氢通入浓H2SO4中
③浓H2SO4滴入萤石(CaF2)中,加热制取HF
④加入少量H2SO4使乙酸乙酯水解.NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是( )
A.①②③④ B.②④ C.④ D.②
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期期中化学卷(解析版) 题型:填空题
铜单质及其化合物在很多领域有重要的用途。
(1)超细铜粉可由[Cu(NH3)4]SO4制备。
① [Cu(NH3 )4]SO4中金属阳离子的核外电子排布式为 。N、O、S三种元素的第一电离能大小顺序为 。(填元素符号)
)4]SO4中金属阳离子的核外电子排布式为 。N、O、S三种元素的第一电离能大小顺序为 。(填元素符号)
②NH3分子中N原子的杂化方式为 ,与NH3互为等电子体的阳离子的化学式为 。
③ SO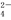 离子的空间构型为 。
离子的空间构型为 。
(2)氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①写出上述制备CuCl的离子方程式: 。
②CuCl的晶胞结构如图所示,其中Cl原子的配位数为 。
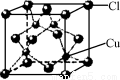
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期期中化学卷(解析版) 题型:选择题
下列有关物质性质及对应用途的说法正确的是( )
A.利用浓硫酸的脱水性,干燥氢气
B.氧化镁熔点高,可用于制造耐火 材料
材料
C.碳酸钠溶液呈碱性,可用于治疗胃酸过多
D.二氧化硫有漂白性,故可使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市四校高一期中联考化学试卷(解析版) 题型:选择题
下列物质中氧原子数目与11.7 g Na2O2中氧原子数一定相等的是 ( )
A.6.72 L CO B.6.6 g CO2 C.24 g SO3 D.9.8 g H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com