
(15分)烧碱(NaOH)和纯碱(Na2CO3)与硫酸、盐酸和硝酸并称为工业上的“三酸两碱”。按要求回答下列问题:
(1)完成下列有关NaOH溶液参加反应的离子方程式
①向NaOH溶液中加入铝片:_______________________;
②向NaOH溶液中滴加少量氯化铝溶液___________________;
③二氧化氮与NaOH溶液发生氧化还原反应:___________________;
④用热的NaOH溶液洗涤沾有硫单质的试管:___________________;
(2)下列是碳酸钠和碳酸氢钠的性质比较,用“>”“<”“=”填空:
①热稳定性:Na2CO3_______NaHCO3;
②与稀盐酸反应快慢:Na2CO3_______NaHCO3;
③物质的量相同时,消耗盐酸的物质的量:Na2CO3_______NaHCO3。
(3)在10 mL 1 mol/L的纯碱溶液中,不断搅拌并逐滴加入10 mL 1.5 mol/L盐酸,完全反应后,在标准状况下生成二氧化碳的体积为____________L。
(4)碳酸钠在工业上具有广泛的作用,碳酸钠可以用作下列工业生产主要原料的是_____(填编号)
a.玻璃 b.水泥 c.造纸 d.海水提取镁
(1)2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
Al3++4OH-=Al(OH)4]- 2NO2+2OH-=NO3-+NO2-+H2O
3S+6OH- 2S2-+SO32-+3H2O(不写条件扣1分)
2S2-+SO32-+3H2O(不写条件扣1分)
(2) ①>;②<;③>(每空均为1分) (3)0.112 (4)a、c(每个1分,错一个倒扣1分)
【解析】
试题分析:(1)①铝能和强碱氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。
②由于氢氧化铝是两性氢氧化物,能溶解在强碱中,因此向NaOH溶液中滴加少量氯化铝溶液生成偏铝酸钠、氯化钠,反应的离子方程式为Al3++4OH-=Al(OH)4]- 。
③二氧化氮与NaOH溶液发生氧化还原反应生成硝酸钠、亚硝酸钠和水,反应的离子方程式为2NO2+2OH-=NO3-+NO2-+H2O。
④在加热的条件下氢氧化钠溶液能溶解单质硫生成亚硫酸钠、硫化钠和水,因此用热的NaOH溶液洗涤沾有硫单质的试管发生反应的离子方程式为3S+6OH- 2S2-+SO32-+3H2O。
2S2-+SO32-+3H2O。
(2)①碳酸氢纳加热易分解生成碳酸钠、水和CO2,所以热稳定性:Na2CO3>NaHCO3;
②碳酸钠与盐酸反应分步进行,即Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑,因此与稀盐酸反应快慢:Na2CO3<NaHCO3;
③根据反应式Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑可知,物质的量相同时,消耗盐酸的物质的量:Na2CO3>NaHCO3。
(3)碳酸钠的物质的量=0.01L×1mol/L=0.01mol,盐酸的物质的量=0.01L×1.5mol/L=0.015mol。碳酸钠与盐酸反应分步进行,则
Na2CO3+HCl=NaCl+NaHCO3
0.01mol 0.01mol 0.01mol
此时还剩余盐酸的物质的量是0.005mol,则
NaHCO3 +HCl=NaCl+H2O+CO2↑
0.005mol 0.005mol 0.005mol
剩余实际生成的CO2是0.005mol
标准状况下的体积=0.005mol×22.4L/mol=0.112L
(4)工业生产玻璃的主要原料是纯碱、石灰石和石英;生产水泥的主要原料是黏土和石灰石;造纸主要原料是植物纤维,但需要用碳酸钠溶解纤维;海水中提取镁主要是一石灰石和盐酸为主要原料,因此答案选ac。
考点:考查氢氧化钠、碳酸钠的性质、用途以及有关方程式书写和计算等


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
(15分)微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极性分子的有 (写化学式)。
⑵下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 。
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.键 h.
键
查看答案和解析>>
科目:高中化学 来源:2011届宁夏银川二中高三第一次模拟考试试题(理综)化学部分 题型:填空题
(15分)微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极性分子的有 (写化学式)。
⑵下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 。
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。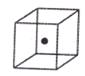
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.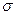 键 h.
键 h.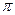 键
键
查看答案和解析>>
科目:高中化学 来源:2010-2011学年宁夏高三第一次模拟考试试题(理综)化学部分 题型:填空题
(15分)微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极性分子的有 (写化学式)。
⑵下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 。
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。
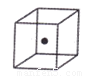
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 。(填字母)
a.金属键 b.离子键
c.非极性键 d.极性键
f.配位键 g. 键 h.
键 h.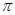 键
键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com