
【题目】把 NaOH、MgCl2、AlCl3 三种固体组成的混合物溶于足量水后,产生 1.16g 白色沉淀, 再向所得浊液中逐渐加入 2.00mol/LHCl 溶液,加入HCl 溶液的体积与生成沉淀的关系如图所示。
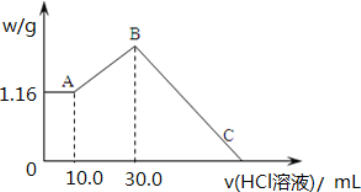
(1)A 点沉淀物的化学式为_____。B 点纵坐标为___________________。
(2)A 点至B 点改为通入二氧化碳气体,至少须标准状况下二氧化碳_____mL。此时发生反应的离子方程式为_____。
(3)B 点含溶质的物质的量是_____mol。C 点(此时沉淀恰好完全溶解)HCl 溶液的体积为_____mL。
【答案】Mg(OH)2 4.28 448 2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32- 0.22 110
【解析】
加入盐酸开始阶段沉淀不溶解,说明反应中氢氧化钠过量,镁离子转化为氢氧化镁沉淀,铝离子转化为偏铝酸钠,氢氧化钠被完全中和后偏铝酸钠和盐酸反应生成氢氧化铝,最后加入的盐酸溶解氢氧化镁和氢氧化铝,结合图象分析解答。
(1)向水中有沉淀物组成的混合溶液中加入盐酸时,0~10mL时没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,即A点沉淀物的化学式为Mg(OH)2;10mL~30mL时盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,该阶段消耗盐酸的物质的量是0.02L×2mol/L=0.04mol,因此生成氢氧化铝是0.04mol,质量是0.04mol×78g/mol=3.12g,则B点纵坐标为3.12+1.16=4.28;
(2)向偏铝酸钠溶液中通入二氧化碳生成氢氧化铝沉淀,方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,0.04mol氢氧化铝消耗0.02mol二氧化碳,标况下的体积是0.02mol×22.4L/mol=0.448L=448mL;
(3)当沉淀质量不再发生变化时溶液中的溶质是NaCl,A点沉淀是氢氧化镁,则n[Mg(OH)2]=1.16g÷58g/mol=0.02mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol;氢氧化铝的物质的量是0.04mol,根据铝离子守恒可知n(AlCl3)=0.04mol,由Cl-离子守恒得B点含溶质氯化钠的物质的量是0.02mol×2+0.04mol×3+0.03L×2mol/L=0.22mol;根据钠离子守恒可知原混合物中氢氧化钠是0.22mol,C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸相当于用于中和原混合物中的NaOH,此时所加盐酸物质的量n(HCl)=n(NaOH)=0.22mol,则C点所表示盐酸的体积为0.22mol÷2mol/=0.11L=110mL。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铅单质及其化合物在新能源领域应用广泛,工业上利用方铅精矿(主要成分为PbS)制备PbSO4的工艺流程如下:
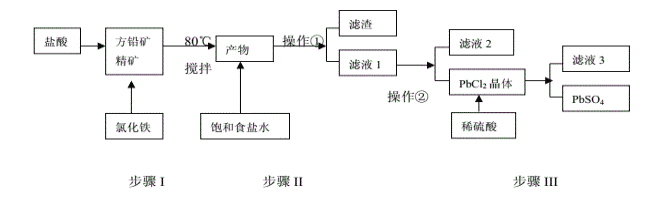
已知:①PbCl2(s)+2Cl-(aq)![]() PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
(1)步骤Ⅰ中发现有淡黄色沉淀生成,请写出离子反应方程式:_______________________;
(2)步骤Ⅰ原料预处理过程中写出一种除搅拌外加快反应速率的办法:_________________;反应温度不宜过高,且需加入过量盐酸保证溶液呈强酸性,原因是:____________________;
(3)操作①应为:_______ ;操作②应为:_________ ;
A、趁热过滤 B、蒸发浓缩,冷却结晶; C、蒸发结晶 D、重结晶
(4)写出步骤III中PbCl2生成PbSO4的离子反应方程式:___________________________ ,该反应的平衡常数K=_______;
(5)铅蓄电池(Pb-PbO2-H2SO4)充电时的阳极反应方程式:_________________________ ;
(6)某铅蓄电池放电时电流为0.2A,可持续放电时间96500s,此时参加反应的Pb的质量为41.4g,求该电池放电的能量转化率α=_________ 。(电池能量转化率的定义:α=实际输出电量/理论输出电量×100%,结果保留两位有效数字,已知法拉第常数为96500C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
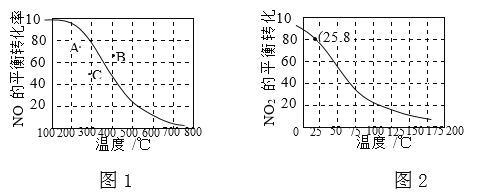
① 图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
② 100kPa、25℃时,2NO2(g)![]() N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 醋酸与氢氧化钠溶液反应:H++ OH-= H2O
B. 碳酸氢钠水解的离子方程式:HCO3-+ H2O ![]() H3O+ + CO32-
H3O+ + CO32-
C. 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
D. 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列判断正确的是
A. 高温下,5.6 g Fe与足量水蒸气反应,转移的电子数为0.3NA
B. 标准状况下,22.4 L NO和11.2 L O2充分反应,产物的分子数为NA
C. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
D. 向含有0.2 mol NH4Al(SO4)2的溶液中滴加NaOH 溶液至沉淀恰好完全溶解,所消耗OH-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
请回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水_________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大_______。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 B.定容时,俯视刻度线
C.定容时,仰视刻度线 D.移液时,有少量液体溅出
(3)若称取样品的质量为1.5g,共配制100mL的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol·L-1盐酸滴定,其用去盐酸的体积为23.0mL,则该样品中N的含量为________。
(滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3)
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρgcm-3,溶质的质量分数为![]() ,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
A. ![]()
B. ![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5![]()
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c (Cl-)>c(NH4+)>c (OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中能说明亚硝酸是弱电解质的是( )
A. 用![]() 溶液做导电试验,灯光较暗
溶液做导电试验,灯光较暗
B. ![]() 是共价化合物
是共价化合物
C. 亚硝酸不与氯化钠反应
D. 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com