
【题目】直接排放含SO2的烟气会形成酸雨危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应原理为__。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式为__。
(3)吸收液吸收SO2的过程中,pH随n(![]() ):n(
):n(![]() )变化关系如表:
)变化关系如表:
n( | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性__(填“酸”或“碱”),用化学平衡原理解释__。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(填字母编号)__。
a.c(Na+)=2c(![]() )+c(
)+c(![]() )
)
b.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:

①![]() 在阳极放电的电极反应式是__。
在阳极放电的电极反应式是__。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理__。
【答案】2SO2+O2+2H2O=2H2SO4 2OH-+SO2=![]() +H2O 酸
+H2O 酸 ![]() 在溶液中会发生水解与电离作用,
在溶液中会发生水解与电离作用,![]()
![]() H++
H++![]() ;
;![]() +H2OOH-+H2SO3,
+H2OOH-+H2SO3,![]() 的电离程度强于水解程度,故溶液呈酸性 ab
的电离程度强于水解程度,故溶液呈酸性 ab ![]() +H2O-2e-=
+H2O-2e-=![]() +3H+ 在阴极室中,H+得到电子生成H2,随着H+浓度的降低,可促使
+3H+ 在阴极室中,H+得到电子生成H2,随着H+浓度的降低,可促使![]() 电离生成
电离生成![]() ,且Na+进入阴极室,吸收液得以再生
,且Na+进入阴极室,吸收液得以再生
【解析】
(1) SO2、氧气、水反应生成硫酸;
(2) NaOH溶液吸收SO2生成Na2SO3和水;
(3) NaHSO3溶液中 n(![]() )<n(
)<n(![]() );
);
(4) ①![]() 在阳极失电子生成
在阳极失电子生成![]() ;
;
②在阴极室中,H+得到电子生成H2,随着H+浓度的降低,可促使![]() 电离生成
电离生成![]() ;
;
(1) SO2、氧气、水反应生成硫酸,反应方程式是2SO2+O2+2H2O=2H2SO4;
(2) NaOH溶液吸收SO2生成Na2SO3和水,反应的离子方程式是2OH-+SO2=![]() +H2O;
+H2O;
(3) ①NaHSO3溶液中 n(![]() )<n(
)<n(![]()
![]() 在溶液中会发生水解与电离作用,
在溶液中会发生水解与电离作用,![]()
![]() H++
H++![]() ;
;![]() +H2OOH-+H2SO3,
+H2OOH-+H2SO3,![]() 的电离程度强于水解程度,故溶液呈酸性;
的电离程度强于水解程度,故溶液呈酸性;
②a.根据电荷守恒,c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-),溶液呈中性时c(Na+)=2c(
)+c(OH-),溶液呈中性时c(Na+)=2c(![]() )+c(
)+c(![]() ) ,故a正确;
) ,故a正确;
b. c(![]() )=c(
)=c(![]() )时液呈碱性,所以溶液呈中性时 c(Na+)>c(
)时液呈碱性,所以溶液呈中性时 c(Na+)>c(![]() )>c(
)>c(![]() )>c(H+)=c(OH-),故b正确;
)>c(H+)=c(OH-),故b正确;
c.根据电荷守恒,c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-),故c错误;
)+c(OH-),故c错误;
选ab;
(4) ①![]() 在阳极失电子生成
在阳极失电子生成![]() ,阳极反应式是
,阳极反应式是![]() +H2O-2e-=
+H2O-2e-=![]() +3H+;
+3H+;
②在阴极室中,H+得到电子生成H2,随着H+浓度的降低,可促使![]() 电离生成
电离生成![]() ,且Na+进入阴极室,吸收液得以再生。
,且Na+进入阴极室,吸收液得以再生。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、![]() (乙)、
(乙)、![]() (丙)的分子式均为C8H8,下列说法正确的是
(丙)的分子式均为C8H8,下列说法正确的是
A. 甲的同分异构体只有乙和丙两种 B. 甲、乙、丙均可与溴的四氯化碳溶液反应
C. 甲、乙、丙的二氯化物种数最少的是丙 D. 甲中所有原子一定处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2 O3、FeO等)生产ZnSO4·7H2O的流程如下:

有关金属离子[c(Mn+)= 0.l mol/L]形成氢氧化物沉淀的pH范围如下表:
金属离 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是____;滤渣1主要成分是____。
(2)“氧化”时的离子方程式为_________;加入ZnO除杂时溶液的pH控制范围是____~5.0。
(3)滤渣3含有锌和____;滤液得到ZnSO4·7H2O的操作是____、洗涤、干燥。
(4)取14.35gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 8. 95 | 8. 05 | 6. 72 | 4.05 |
则680℃时剩余固体的化学式为________(填序号)。
A.ZnO B.Zn3O(SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤常温下,分别取滤液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.加入过量氨水:Fe3+、![]() 、
、![]() 、OH-
、OH-
B.加入过量NaOH溶液:Na+、[Al(OH)4]-、![]() 、OH-
、OH-
C.加入过量H2O2溶液:Fe2+、H+、![]() 、Cu2+
、Cu2+
D.加入过量 NaHCO3溶液:Na+、Al3+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列叙述正确的是
A.1L0.1mol/LNH4Cl溶液中,![]() 的数量为0.1NA
的数量为0.1NA
B.0.1mol的14C中,含有0.6NA个中子
C.标准状况下,2.24LN2和O2的混合气体中原子数为0.2NA
D.16g甲烷和1mol白磷中含有的化学键数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.![]() 与
与![]() 互为同系物
互为同系物
B.分子组成为C4H8O2,其中属于酯的结构有4种
C.乙醇和乙醚互为同分异构体
D.具有相同的分子通式的有机物一定是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲苯为原料合成某种食用香料(有机物G)和某种治疗肺结核药物的有效成分(有机物PASNa)的路线如下:
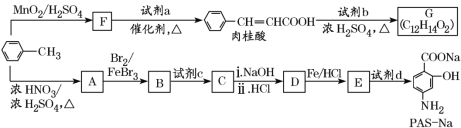
已知:①
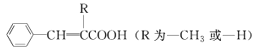
②![]()
③![]()
回答下列问题:
(1)肉桂酸中所含官能团的名称是______________。
(2)①试剂a的结构简式是________________。
②写出由A生成B的化学方程式:____________________。
(3)已知试剂b为相对分子质量为60的醇,且无支链,写出G的结构简式:________________,由肉桂酸制取G的反应类型是________。
(4)①当试剂d过量时,可以选用的试剂d是_____(填字母)。
a.NaOH b.Na2CO3 c.NaHCO3
②参照题中信息,设计以![]() 为起始原料制备
为起始原料制备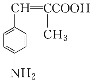 的合成路线。
的合成路线。
____________________。
(5)在肉桂酸分子中碳碳双键催化加氢后得到化合物X(分子式为C9H10O2),X有多种同分异构体,符合下列条件的有________种。写出其中一种处于对位且核磁共振氢谱中比例为6:1:2:2:1的结构简式______________________________。
a.苯环上有两个取代基
b.能发生银镜反应
c.与Na作用有H2产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 同时满足下列条件:①含苯环且不含甲基;②苯环上一氯取代物只2种;③
同时满足下列条件:①含苯环且不含甲基;②苯环上一氯取代物只2种;③![]() 与足量的
与足量的![]() 反应生成
反应生成![]() ;④遇
;④遇![]() 溶液不显色.A如图所示转化关系:
溶液不显色.A如图所示转化关系:
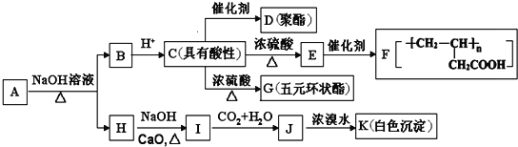
已知:![]()
回答下列问题:
(1)E中官能团名称_____,H的分子式为_______.
(2)由C生成G的反应类型是________.
(3)A的结构简式为____,G的结构简式为_________.
(4)①写出CD反应的化学方程式_________;
②写出I→J反应的离子方程式_____________.
(5)C的同分异构体中能同时满足下列条件:a.能发生银镜反应,b.能发生皂化反应;c.能与![]() 反应产生
反应产生![]() ,共有_____种(不含立体异构).其中核磁共振氡谱显示为3组峰,且峰面积比为6:1:1的是_________(写结构简式).
,共有_____种(不含立体异构).其中核磁共振氡谱显示为3组峰,且峰面积比为6:1:1的是_________(写结构简式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com