
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
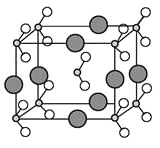
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
【答案】(1)[Ar]3d104s1 (2)N>O>C (3)高于
B的氢化物分子之间存在氢键 (4)[N=C=O]- (5)sp
(6)NaNO2 (7)Cu+外围电子3d10轨道全满稳定,Cu2+外围电子3d9轨道电子非全满和半满状态不稳定,所以CuO在加热条件下容易转化为Cu2O
【解析】试题分析:原子序数依次增大的A、B、C、D、E、F六种元素,A的基态原于有3个不同的能级,各能级中的电子数相等,则A是C元素;C的基态原子2p能级上的未成对电子数与A原子的相同,C原子序数大于A,则C为O元素;B原子序数大于A而小于C,则B是N元素;E和C位于同一主族,且E原子序数小于29,则C是S元素;D为它所在周期中原子半径最大的主族元素,原子序数小于S,则D是Na元素;F的原子序数为29,为Cu元素;
(1)F是Cu元素,其原子核外有29个电子,根据构造原理知Cu元素基态原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)A、B、C分别是C、N、O元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以电离能从小到大顺序是N>O>C;
(3)含有氢键的氢化物熔点较高,氨气分子中含有氢键、甲烷中不含氢键,所以氨气熔沸点高于甲烷;
(4)等电子体原子个数相等、价电子数相等,由C、N、O形成的离子OCN-与CO2互为等电子体,根据二氧化碳结构式知OCN-的结构简式为[N=C=O]-;
(5)在元素C与S所形成的常见化合物CS2中,二硫化碳分子中中心原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;
(6)由N、O、Na三种元素形成的化合物晶体的晶胞如图所示,该晶胞中N原子个数=1+8×1/8=2、O原子个数=2+16×1/8=4,Na原子个数=8×1/4=2,所以该晶胞中Na、N、O原子个数之比=2:2:4=1:1:2,则化学式为NaNO2;
(7)在原子中电子层全满、半满和全空为稳定状态,Cu+外围电子3d10轨道全满稳定,Cu2+外围电子3d9轨道电子非全满和半满状态不稳定,所以CuO在加热条件下容易转化为Cu2O。


科目:高中化学 来源: 题型:
【题目】有些古文或谚语包含了丰富的化学知识。下列解释错误的是
选项 | 古文或谚语 | 化学解释 |
A | 日照香炉生紫烟 | 碘的升华 |
B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
C | 煮豆燃豆萁 | 化学能转化为热能、光能 |
D | 雷雨肥庄稼 | 自然固氮 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是( )
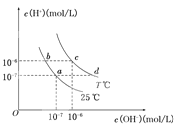
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl―、SO42―
B.b点对应的溶液中大量存在:NH4+、Ba2+、OH―、I―
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl―、HCO3―
D.d点对应的溶液中大量存在:Na+、K+、SO32―、Cl―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于粒子结构的描述不正确的是( )。
A. H2S和NH3均是价电子总数为8的分子
B. HS-和HCl均是含一个极性键的18电子粒子
C. CO2的电子式为![]()
D. 1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是( )
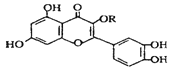
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为乙基则该物质的分子式可以表示为C16H14O7
C.lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
D.lmol该化合物最多可与7mol Br2完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
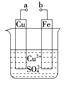
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b连接时,铜片上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且能够防止环境污染,现按以下方式进行处理利用:
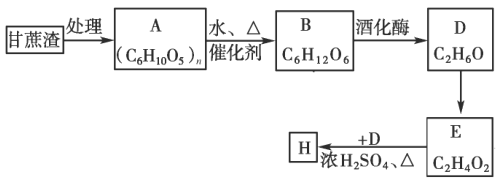
试回答:
(1)A的名称是____________;
(2)写出D的同分异构体的结构简式____________。
(3)D到E的反应类型为____________,D到E的反应试剂可以为____________。
(4)实验室制备H后,提纯H的分离方法为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,
[Cu(OH)4] 2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。

(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0pm,密度为________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为______________pm(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com