
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。

步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。
分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05 g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79 g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95 g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是___。
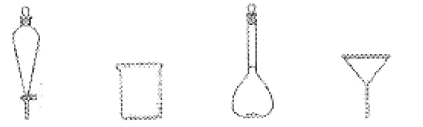
(2)步骤2中,图中所示装置中仪器A的名称是___,其作用为___。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是___;分离有机相的操作名称为__,分离有机相时不需要用到下列玻璃仪器中的__ (填名称)。
(4)实验中可能生成的有机副产物结构简式为____ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为___%。实际产率低于理论值的原因有多种,下列所述原因中不可能的是___ (填字母)。
a.分水器收集的水里含丙烯酸甲酯 b.本实验条件下发生了副反应
c.产品在洗涤、蒸发过程中有损失 d.产品精制时收集部分低沸点物质
(6)本实验中需要采取的安全防护措施有____。
【答案】防止爆沸; 球形冷凝管; 冷凝回流; 中和丙烯酸,溶解丙烯醇,降低丙烯酸甲酯的溶解度; 分液; 容量瓶,漏斗; CH3OCH3; 75%; bd; 使用四氯化碳溶液进行尾气处理,实验要在通风橱中进行;
【解析】
该实验是利用丙烯酸和甲醇发生酯化反应制取丙烯酸甲酯的实验,冷凝管的作用主要是用于冷凝回流,碳酸钠溶液的作用,主要是用来中和丙烯酸,溶解甲醇,降低酯类物质的溶解度,由于发生酯化反应,实验的条件为浓硫酸加热同时有甲醇参与,所以能发生甲醇不完全消去生成甲醚的副反应,产率的计算可根据过量少量进行判断;
(1)步骤1中,加入碎瓷片的目的是为了防止爆沸;
(2)仪器A的名称是球形冷凝管,冷凝管的作用为冷凝回流;
(3)碳酸钠可以中和丙烯酸,溶解甲醇,降低丙烯酸甲酯的溶解度;分离有机相和水,可以通过分液的方式;需要用到的仪器主要有容量瓶和烧杯;
(4)实验的条件为浓硫酸加热同时有甲醇参与,所以能发生甲醇不完全消去生成甲醚的副反应;
(5)根据表中数据得出,甲醇有7.9g,丙烯酸有10g,所以甲醇有0.25mol,丙烯酸有0.11mol,根据反应方程式得出,二者1:1反应,说明甲醇过量,所以根据丙烯酸的物质的量计算,0.11mol丙烯酸理论上可以生成0.11mol的丙烯酸甲酯,所以理论丙烯酸甲酯的产量为8.6g,所以计算产率得到![]() ;
;
(6)由于本实验中含有有毒气体,同时有毒气体可溶于有机溶液中,所以要在通风橱中进行实验,同时可以用有机溶剂四氯化碳来吸收有毒气体;


科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
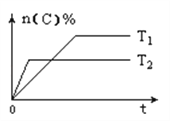
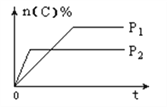
A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:(填“加快”、“不变”或“减慢”)。
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:(填“加快”、“不变”或“减慢”)。
①保持体积不变充入Ne,其反应速率___。
②保持压强不变充入Ne,其反应速率____。
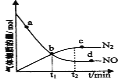
(2)在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
5N2(g)+6H2O(g)。某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
(3)一定条件下,在2L密闭容器内,发生反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用NO2表示0~2s内该反应的平均速率为___。
②在第5s时,NO2的转化率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)硫化钠(Na2S)俗称硫化碱,常用于印染及制药工业。将硫化钠溶于水,会导致水的电离程度____(该“增大”、“减小”威“不变”);若微热该溶液,pH会___(填“增大”、“减小”或“不变”)。
(2)硫氢化钠(NaHS)常用作有机合成的中间体,其水溶液呈碱性。NaHS溶液中Na+、H+、HS-,OH-离子浓度由大到小的顺序为____。
(3)若向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,可发生以下反应:
Na2S+Na2SO3+H2SO4→Na2SO4+S↓+H2O(未配平)
①配平化学方程式:__Na2S+__Na2SO3+__H2SO4=__Na2SO4+__S↓+__H2O
②反应中还原产物与氧化产物的物质的量之比是__
(4)室温时,已知H2S的Ka1=1×10-7,Ka2=1×10-13,若只考虑S2-的第一步水解,则 0.1 mol·L-1Na2S溶液pH约__
(5)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为:Cu2+(aq)+FeS(s)![]() CuS(s)+Fe2+(aq)。下列有关叙述中正确的是___
CuS(s)+Fe2+(aq)。下列有关叙述中正确的是___
a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 0.1 mol/L 的CH3COOH 溶液加水稀释或加热均可使CH3COO-的物质的量增多
B. 0.1 mol/L 的CH3COOH 溶液加水稀释,c(CH3COO-)/[c(CH3COOH) ·c(OH-)]不变
C. 向0.1 mol/L CH3COOH溶液中加入少量纯醋酸,平衡向右移动,电离程度增大
D. 0.1 mol/L CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O42H2O工艺流程如下

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O42H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由N2和H2反应生成1molNH3需要放出___kJ的热量。
(2)把0.2molX气体和0.4molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g);2min末生成0.3molW。若测知Z的浓度变化表示的反应速率为0.05mol/(Lmin)。计算:
①前2min内用Y的浓度变化表示的反应速率为___。
②化学方程式中n的值是___。
(3)某温度时在2L容器中A、B、C三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
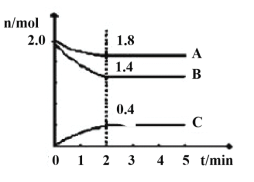
该反应的化学方程式为____。
下列叙述能说明上述反应达到平衡状态的是___。
A.混合气体的平均摩尔质量不随时间的变化而变化
B.相同时间内消耗2nmol的A的同时生成4nmol的C
C.混合气体的密度不随时间的变化而变化
D.容器内压强不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com