
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4 )2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
A.a点发生反应的离子方程式是:
Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓
B.b点消耗Ba(OH)2溶液体积为200mL
C.从a→b 、b→c点过程中发生反应的离子方程式依次为:NH4++OH-=NH3·H2O;Al(OH)3+OH-=AlO2-+2H2O
D.沉淀的质量:a点>c点
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源:2016-2017学年天津市宝坻区高二11月联考化学试卷(解析版) 题型:选择题
下列各组离子中能在溶液中大量共存,且溶液呈碱性透明的是( )
A、Na+、OH-、H2PO4-、NO3-
B、AlO2-、K+、CO32-、Na+
C、Al3+、Cl-、AlO2-、Na+
D、Fe2+、K+、H+、NO3-
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三新考试大纲适应性考试化学卷(解析版) 题型:选择题
化学在生产和生活中有着重要的作用。下列有关说法正确的是
A.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
B.含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中
C.施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D.最理想的“原子经济"就是原子利用率为100%
查看答案和解析>>
科目:高中化学 来源:2017届广西省钦州市钦州港区高三12月月考化学试卷(解析版) 题型:选择题
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A.正极反应式:Ca + 2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针发生偏转
D.每转移0.1mol电子,理论上生成10.35 g Pb
查看答案和解析>>
科目:高中化学 来源:2017届广西省钦州市高新区高三12月月考化学试卷(解析版) 题型:填空题
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“ =”或“<”)。
=”或“<”)。
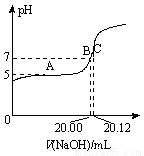
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________。
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期期中化学试卷(解析版) 题型:填空题
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ﹒脱硝:
已知:H2的燃烧热为285.8kJ·mol—1
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol—1
H2O(g)=H2O(l) ΔH=—44kJ·mol—1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为: ;
Ⅱ﹒脱碳:
向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH﹤0
CH3OH(l)+H2O(l) ΔH﹤0
⑴①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 (填字母)
A﹒混合气体的平均相对分子质量保持不变
B﹒CO2和H2的体积分数保持不变
C﹒CO2和H2的转化率相等
D﹒混合气体的密度保持不变
E﹒1molCO2生成的同时有3molH—H键断裂
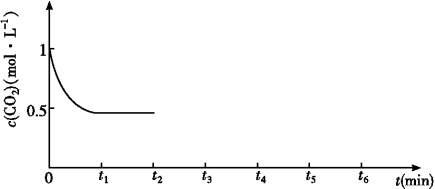
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2浓度随时间的变化曲线。
⑵改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ) K(Ⅱ)(填“﹥”“﹤”或“=”)
②对反应Ⅰ,前10min内的平均 反应速率v(CH3OH)= 。在其他条件不变的情况下,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡 移动(填“正向”“逆向”或“不”)。
反应速率v(CH3OH)= 。在其他条件不变的情况下,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡 移动(填“正向”“逆向”或“不”)。
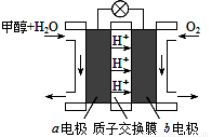
⑶利用CO与H2可直接合成甲醇,下图是由“甲醇—空气”形成的绿色燃料电池的工作原理
示意图,写出以石墨为电极的电池工作时负极的电极反应式
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期期中化学试卷(解析版) 题型:选择题
甲、乙、丙、丁为四种主族元素,甲元素与乙、丙、丁三种元素直接相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断正确的
A. 原子半径:丙>乙>甲>丁
B. 气态氢化物的稳定性:甲>丙
C. 最高价氧化物对应的水化物的酸性:丁>甲
D. 乙和甲、乙和丁所能形成的化合物都是剧毒物质
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:填空题
依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如下图所示。

请回答下列问题:
(1)电极X的材料是___________,电解质溶液Y是___________;
(2)银电极为电池的___________极,发生的电极反应为_________;X电极上发生的电极反应为___________。
(3)外电路中的电子是从___________电极流向_________电极。
(4)硫酸铜溶液PH<7 的原因是 (用离子方程式解释)
的原因是 (用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
下列叙述正确的是
A. 1 mol CO2 的质量为44g/mol
B. CO2的摩尔质量为44g
C. CO2的摩尔质量等于CO2的相对分子质量
D. NA个CO2的质量与CO2的相对分子质量在数值上相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com