
下列叙述正确的是( )

A. 碱金属元素是指IA族的所有元素
B. 副族元素没有非金属元素
C. 同周期第ⅡA族和第IIIA族的元素,原子序数之差只能是1或25
D. 部分卤族元素的某种性质A随核电荷数的变化趋势如右上图所示, 则A可能表示单质的熔沸点
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列各组物质与用途关系不正确的是( )
A. 过氧化钠:供氧剂 B. 二氧化硅:半导体
C. 明矾:净水剂 D. 三氧化二铁:红色油漆
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:选择题
向含Na+、Al3+、Fe3+、Fe2+、Cl-、SO42-的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,所得溶液与起始溶液相比,上述离子数目没有变化的有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:填空题
X、Y、Z、W、T是原子序数依次増大的五种短周期元素,且X、Y、Z、W的原子序数之和为32。其中X是元素周期表中原子半径最小的元素,Y、Z左右相邻,Z、W位于同一主族。T的单质常用于自来水的杀菌消毒。
请回答下列问题:
(1)W元素在周期表中的位置为:____________________
(2)由 X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的离子方程式为____________________。
(3)Y元素的气态氢化物与其最高价氧化物的水化物可以相互反应,写出其离子方程式:______________
(4)Y和T两元素的非金属性强弱为Y________T (填“>”“<”或者“=”)。可以验证该结论的方法是___________________
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(5)某化学兴趣小组欲通过实验探究元素N、C、Si 非金属性强弱。实验装置如下:
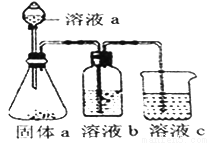
①溶液a和溶液b分别为__________溶液、________溶液(填溶质化学式)
②经验证,N、C、Si的非金属性由强到弱为:__________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:选择题
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z B. 单质沸点:X>Y>Z
C. 离子半径:X2->Y+>Z- D. 原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:简答题
二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) ∆H1
CH3OCH3(g)+H2O(g) ∆H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) CH3OH(g) ∆H2=-90.7 kJ·mol-1
CH3OH(g) ∆H2=-90.7 kJ·mol-1
③2CH3OH(g) CH3OCH3(g)+H2O(g) ∆H3
CH3OCH3(g)+H2O(g) ∆H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如下:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
则∆H1=__________kJ·mol-1、∆H3=__________kJ·mol-1
(2)反应①的化学平衡常数表达式为_____________。
制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______________。

下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=_____________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因___________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:选择题
某油脂X可由甘油(丙三醇:C3H8O3)和油酸(C18H34O2)脱水形成。已知1mol甘油和3mol油酸反应得到1molX,X的分子式是
A. C57H104O6 B. C57H108O6 C. C57H106O6 D. C57H102O6
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:推断题
已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
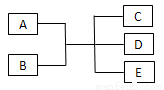
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
明代《本草纲目》记载了民间酿酒的工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离( )
A. 汽油和氯化钠溶液 B. 39%的乙醇溶液
C. 氯化钠与单质溴的水溶液 D. 硝酸钾和氯化钠的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com