
【题目】从海藻灰中可以提取碘的主要反应为:2 I-+Cl2=2 Cl-+I2,下列说法正确的是)( )
A.该反应属于置换反应 B.I-具有氧化性
C.1mol氯气转移了1mol电子 D.Cl2是还原剂
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】回归、改进、拓展教材实验,是高考化学实验考查的常见形式。
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究。基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理。
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式__________________________________。
(2)①该催化剂中铁元素的化合价为 。
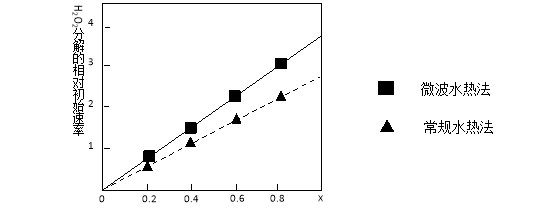
②下图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是 。
II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+ 对该反应有催化作用
假设3:K+ 对该反应有催化作用
【设计、完成实验】
(3)称取 g草酸晶体(H2C2O4·2H2O),配制500 mL 0.10 mol/L H2C2O4溶液。在上述过程中必须用到的2种定量仪器是托盘天平和
(4)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
仔细阅读分析表中数据,回答问题:
x = mL,假设__________成立(填“1” 、“2”或“3”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制乙酸乙酯的装置。
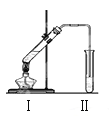
(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是 。
(2)为了证明浓硫酸的作用,某同学进行了以下4个
实验,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18molL﹣1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3molL﹣1硫酸 | 饱和Na2CO3溶液 | 1.2 |
D | 3mL乙醇、2mL乙酸、6mL6molL﹣1盐酸 | 饱和Na2CO3溶液 | 1.2 |
①为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴 试液,每次实验结束后可观察到试管Ⅱ中的现象是 ,
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是 、 ;实验D和实验C对照,你又能得出的结论是 。
(3)饱和Na2CO3溶液的作用是____________________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.01 mol/L硫氰化钾与氯化铁溶液各100 mL在一定条件下反应:3KSCN +FeCl3![]() Fe(SCN)3 + 3KCl,达到平衡后向混合溶液加入5g下列固体(溶液体积变化忽略不计),不影响平衡的是
Fe(SCN)3 + 3KCl,达到平衡后向混合溶液加入5g下列固体(溶液体积变化忽略不计),不影响平衡的是
A.氯化铁 B.氯化钾 C.硫氰化钾 D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.3gNa、Na2O、Na2O2的混合物与足量水反应,在标准状况下得到672ml混合气体,将该混合气体通过放电恰好反应,则原混合物中Na、Na2O、Na2O2的物质的量之比为( )
A: 1:2:1 B: 1:1:1 C: 1:3:1 D: 4:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯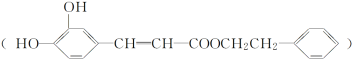 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。
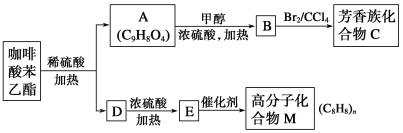
请回答下列问题:
(1)A分子中的官能团是_______________________________。
(2)E→M的反应类型为________;B→C的反应类型为__________。
(3)高分子化合物M的结构简式是_______________________________。
(4)写出A→B反应的化学方程式:__________________________________。
(5)A的同分异构体有很多种,其中同时符合下列条件的同分异构体有________种。
①苯环上只有两个取代基 ②能发生银镜反应
③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公安部发布法令:从2011年5月1日起,醉酒驾驶机动车将一律入刑。下列关于酒精的叙述错误的是( )
A.化学名称为乙醇
B.易挥发
C.常用作有机溶剂
D.不能被酸性高锰酸钾氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体
A.①②⑤ B.②③⑥ C.②③④⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com