
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:
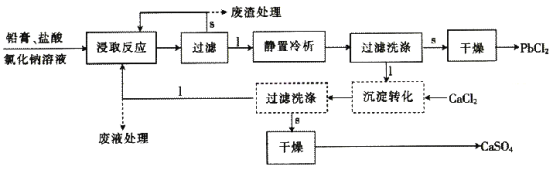
已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
【答案】PbO2 Pb+SO42--2e-==PbSO4 PbO2+4HCl==PbCl2+Cl2↑+2H2O 氧气 空气(或氧气) PbCl2水解生成HCl,超过70℃时HCl易挥发 延长浸取时间或充分搅拌 容易形成PbSO4沉淀而导致氯化铅的回收率低
【解析】
(1)由铅蓄电池的总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,氧化剂做正极,还原剂做负极,所以正极材料是PbO2,放电时负极的电极反应式为:Pb+SO42--2e-==PbSO4。答案:PbO2;Pb+SO42--2e-==PbSO4。
(2) 由PbO2能与HCl反应产生一种黄绿色气体为氯气,所以该反应的化学方程式是PbO2+4HCl==PbCl2+Cl2↑+2H2O 。浸取过程中Pb与盐酸反应产生的H2可能会与氧气或空气等混合发生爆炸。答案:PbO2+4HCl==PbCl2+Cl2↑+2H2O;氧气;空气(或氧气)。
(3) 因为PbSO4+2NaCl==PbCl2+Na2SO4 且PbCl2+2H2O![]() Pb(OH)2+2HCl,当温度高于70℃时,PbCl2水解生成的HCl易挥发,促进了水解,所以浸取率不高,为了提高浸取率,还可以采取的措施是延长浸取时间或充分搅拌。答案:PbCl2水解生成HCl,超过70℃时HCl易挥发;延长浸取时间或充分搅拌。
Pb(OH)2+2HCl,当温度高于70℃时,PbCl2水解生成的HCl易挥发,促进了水解,所以浸取率不高,为了提高浸取率,还可以采取的措施是延长浸取时间或充分搅拌。答案:PbCl2水解生成HCl,超过70℃时HCl易挥发;延长浸取时间或充分搅拌。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是形成了PbSO4沉淀而导致氯化铅的回收率低。答案:容易形成PbSO4沉淀而导致氯化铅的回收率低。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明: ![]() 不稳定,不考虑)
不稳定,不考虑)
请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知, ![]() ,则
,则![]() 和
和![]() 等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
(5)常温下, ![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() 的电离平衡常数Ka_______________。
的电离平衡常数Ka_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下向20mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化)。下列说法中正确的是( )
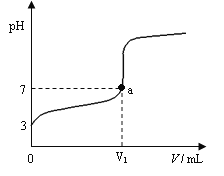
A. 该温度下醋酸的电离平衡常数约为1×10-5mol·L-1
B. 图中V1>20mL,且a点对应的溶液中:c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-)
C. 图中V1<20mL,且a点对应的溶液中:c (CH3COOH) + c (CH3COO-) <c (Na+)
D. 当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH) + c (H+) > c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )

A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1
C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度 B.加入催化剂
C.再加入n molCO和n molH2O D.再加入2n molCO2和2n molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子。将氢气加入到石墨烯排列的六角晶格中可得最薄的导电材料石墨烷(如下图),下列说法中正确的是
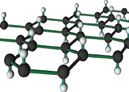
A. 石墨烯与石墨烷互为同系物
B. 石墨烯转变为石墨烷可看作取代反应
C. 石墨烯在氧气中完全燃烧,只产生二氧化碳气体。
D. 石墨烷的化学式通式是CnH2n+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚砂(SiC)可由SiO2和碳在一定条件下反应制得,反应方程式为SiO2+3C![]() SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
SiC+2CO↑,下列有关制造金刚砂的说法中正确的是
A. 该反应中的氧化剂是SiO2,还原剂为C
B. 该反应中的氧化产物和还原产物的物质的量之比为1∶2
C. 该反应中转移的电子数为12e-
D. 该反应中的还原产物是SiC、氧化产物是CO,其物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所选择的试剂、装置或仪器(夹持装置已略 去)能达到相应实验目的的是
A. 提取溴水中的溴
B. 验证石蜡油分解产物中含有烯烃
C. 验证H2O2 分解时二氧化锰的催化效果优于氯化铁
D. 量取20.00mL 0.1000mol/L HCl溶液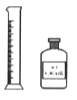
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com