
【题目】我国某科研团队设计了一种新型能量存储/转化装置(如图所示),闭合K2、断开K1时,制氢并储能。下列说法正确的是
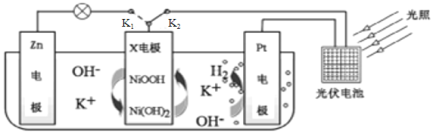
A.制氢时,X电极附近pH增大
B.断开K2、闭合K1时,装置中总反应为Zn+2NiOOH+2H2O=Zn(OH)2+2Ni(OH)2
C.断开K2、闭合K1时,K+向Zn电极移动
D.制氢时,每转移0.1NA电子,溶液质量减轻0.1g
【答案】B
【解析】
A.X电极为电解池阳极时,Ni元素失电子、化合价升高,故X电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O,X电极附近pH减小,故A错误;
B.断开K2、闭合K1时,构成原电池,供电时,X电极作正极,发生还原反应,氧化剂为NiOOH,Zn作负极,发生氧化反应,装置中总反应为Zn+2NiOOH+2H2O=Zn(OH)2+2Ni(OH)2,故B正确;
C.断开K2、闭合K1时,构成原电池,X电极作正极,Zn作负极,阳离子向正极移动,则K+向X电极移动,故C错误;
D.制氢时,为电解池,Pt电极上产生氢气,Pt电极反应为:2H2O+2e-= H2↑+2OH-,X电极反应式为:Ni(OH)2-e-+OH-=NiOOH+H2O,根据电极反应,每转移0.1NA电子,溶液质量基本不变,故D错误;
答案选B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池放电时,发生还原反应的物质是________;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的_____ (填“正”或“负”)极相连。
(3)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 |
①实验操作I的名称________ 则加入H2O2的目的是____________________。
②乙同学认为应将方案中的pH调节到8,你认为此观点_____(填“正确”或“不正确”),理由是_________。
(4)该蓄电池充电时阴极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量关系图,下列分析正确的是

A. 该反应是吸热反应
B. 曲线a的热效应大
C. 该反应的热化学方程式为:4HCl + O2 → 2Cl2 +2H2O + 115.6 kJ
D. 若反应生成2mol液态水,放出的热量高于115.6kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。

已知:
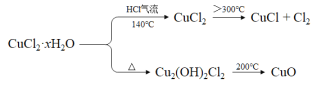
完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息
① 若杂质是CuCl2,则产生的原因可能是____________________________________。
② 若杂质是CuO,则产生的原因可能是_____________________________________。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______(填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________(精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况___。(双线桥法表示)
(2)浓盐酸在反应中显示出来的性质是___(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为___mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的___倍(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化可得到有机物(CH3)2C=C(CH3)2(以下用A表示)。
(1)A的系统命名为________;A在通常状况下呈________(填“气”“液”或“固”)态。
(2)A与Br2的加成产物B与NaOH的乙醇溶液共热可生成二烯烃C,则C的结构简式为___________________;B生成C的反应类型为________。
(3)C与一定量Br2反应可能生成D、E和G,而D与HBr的加成产物只有F,则D形成高分子化合物的化学方程式为__________________________________________。
(4)C的同分异构体中不可能为________(填字母)
a.芳香烃 b.炔烃 c.环烯烃 d.二烯烃
若C的一种同分异构体H与KMnO4酸性溶液生成己二酸,则H的结构简式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是![]()
![]()
A. 混合物:水玻璃、碱石灰、明矾 B. 酸:稀硫酸、次氯酸、硫酸氢钠
C. 酸性氧化物:![]() 、
、![]() 、
、![]() D. 碱性氧化物:CaO、
D. 碱性氧化物:CaO、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p[![]() ]=-lg[
]=-lg[![]() ]。室温下,向0.10 mol/L HX溶液中滴加0.10 mol/LNaOH溶液,溶液pH随p[
]。室温下,向0.10 mol/L HX溶液中滴加0.10 mol/LNaOH溶液,溶液pH随p[![]() ]变化关系如图所示。下列说法正确的是
]变化关系如图所示。下列说法正确的是
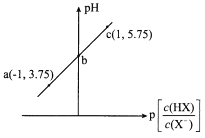
A.溶液中水的电离程度:a>b>c
B.c点溶液中:c(Na+)=10c(HX)
C.室温下NaX的水解平衡常数为10-4.75
D.图中b点坐标为(0,4.75)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com