
����Ŀ���������ӷ���ʽ��д��ȷ����(����)
A.��NH4Al(SO4)2��Һ�еμ������ռ���Һ��Al3+��4OH-=![]() ��2H2O
��2H2O
B.�ں������ʵ���Ũ�ȵ�Na2CO3��NaOH��Һ�еμӹ��������![]() ��OH-��2H+=
��OH-��2H+=![]() ��H2O
��H2O
C.��Mg(HCO3)2��Һ�еμӹ����ij���ʯ��ˮ��Mg2+��2![]() ��2Ca2+��4OH-=Mg(OH)2����2CaCO3����2H2O
��2Ca2+��4OH-=Mg(OH)2����2CaCO3����2H2O
D.��Fe(NO3)2ϡ��Һ�еμ�����NaHSO4��Һ��Fe2+��![]() ��2H+=Fe3+��NO2����H2O
��2H+=Fe3+��NO2����H2O
���𰸡�C
��������
A����NH4Al(SO4)2��Һ�еμ������ռ���Һ���������ȷ�����Ӧ������������������Al3+��3OH-=Al(OH)3������A����
B���ں������ʵ���Ũ�ȵ�Na2CO3��NaOH��Һ�еμӹ��������![]() ��OH-��3H+=2H2O+CO2������B����
��OH-��3H+=2H2O+CO2������B����
C��Mg(OH)2�ܽ�ȱ�MgCO3��С����Mg(HCO3)2��Һ�еμӹ����ij���ʯ��ˮ���ɸ����ܵ�Mg(OH)2��Mg2+��2![]() ��2Ca2+��4OH-=Mg(OH)2����2CaCO3����2H2O����C��ȷ��
��2Ca2+��4OH-=Mg(OH)2����2CaCO3����2H2O����C��ȷ��
D����Fe(NO3)2ϡ��Һ�еμ�����NaHSO4��Һ����NO��3Fe2+��![]() ��4H+=3Fe3+��NO����2H2O����D����
��4H+=3Fe3+��NO����2H2O����D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������Ҫ�Ļ���ԭ��֮һ���㷺Ӧ�����Ṥ�ջ������ġ�ʳƷ��ҵ����ҵ��
(1)����̼�����к����Ȼ������ʣ�ѡ�������Լ����ʵ�鷽�����м��飬�Լ���ϡH2 SO4��BaCl2��Һ��Ca(NO3)2��Һ��AgNO3��Һ
ʵ�鲽�� | �� �� |
��ȡ������Ʒ��������ˮ�ܽ� | �ڹ�����ȫ�ܽ�õ���ɫ������Һ |
��_____ | ���а�ɫ�������� |
�ݾ��ã�________ | �� ________ |
(2)��AgNO3����Һ�ζ�Cl-(��K2CrO4��ҺΪָʾ����Ag2CrO4Ϊש��ɫ����)�����ⶨ̼���ƵĴ��ȡ�
��������Ʒ��Һ����ȡij̼������Ʒmg��������ƿ����100 mL��Һ������ʱ����____������ˮ���̶��ߡ�
������AgNO3��Һ��Ũ�ȱ궨����ȡAgNO3����8.5 g���ձ��У���____ȡ500 mLˮ�������ձ��У�����ҡ�Ⱥ�ת��____ɫ�Լ�ƿ�����ڰ��������á���NaCl����Һ�궨����AgNO3��ҺŨ��Ϊb mol/L��
�۵ζ���Ʒ��ȡ��Ʒ��Һ20. 00 mL����ƿ�У��ӹ���ϡHNO3������2��3��K2 CrO4��Һ����AgNO3����Һ�ζ����ζ��յ������Ϊ_________��
�ظ������������Ρ��Ĵβⶨ�������±���
ʵ����� | 1 | 2 | 3 | 4 |
����AgNO3��Һ���/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
���ڵζ��յ��ȡ�ζ��̶ܿ�ʱ���ӱ�ҺҺ�棬��ⶨ���____(����ƫ��������ƫ����������Ӱ����)����Ʒ�Ĵ���Ϊ____%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ���ǣ���
A.![]() 1��3��4-���ױ�
1��3��4-���ױ�
B.![]() 3-����ϩ
3-����ϩ
C.![]() 2-��-1-����
2-��-1-����
D.![]() 1��3-�������
1��3-�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��ij���Ϊ5L���ܱ������н��У��ڴ�0��3���Ӹ����ʵ����ı仯�����ͼ��ʾ(A��B��C��Ϊ����)
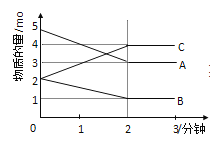
��1���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��2�����º����£�N2(g)+3H2(g) ![]() 2NH3(g)���ﵽƽ��ı�־��_______________��
2NH3(g)���ﵽƽ��ı�־��_______________��
A��3v��(H2)=2v��(NH3)
B���������������������ʱ��仯
C�������ڵ�ѹǿ������ʱ����仯
D�� N2��H2��NH3��Ũ��֮��Ϊ1:2:3
E����λʱ������nmolN2��ͬʱ����3nmolH2
F���Ͽ�һ��N��N����ͬʱ��6��N��H������
������Ϊȼ�ϵ�ȼ�ϵ�أ���������Ч�ʸߵ��ص㣬���ⰱ���������ߣ���Һ����������������棬�Ǻܺõ���Դ���塣ȼ�ϵ�صĽṹ��ͼ��ʾ��
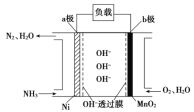
��a���ǵ�ص�______________�������������������������缫��ӦʽΪ________________��
�ڵ�����0.5molN2ʱ����·��ͨ���ĵ��ӵ����ʵ���Ϊ_____��
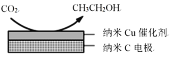
�״�ˮ�����������ⷽ����Ŀǰ�Ƚϳ�������ⷽ�����Ҿ������õ�Ӧ��ǰ�����״�ˮ������������IJ��ַ�Ӧ������ͼ��ʾ��
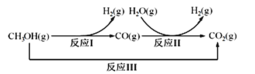
��1����֪һ��������
��ӦI�� CH3OH(g)=CO(g)+2H2(g) ��H1=+90.7kJ/mol
��ӦIII��CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ��H3=+49.5kJ/mol
�������·�ӦII���Ȼ�ѧ����ʽ��____________________________��
��2����ͼ�����Ե������Һ�У����CO2�����Ʊ��Ҵ���д�������ĵ缫����ʽ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֧�Թ��зֱ����������ͬ����ɫ��Һ�������²�����������ȷ����(����)
ѡ�� | ���������� | ���� |
A | ����AgNO3��Һ�����ɰ�ɫ�������ټ�ϡ����������ܽ� | ԭ��Һ����Cl-���� |
B | ͨ��Cl2����Һ��Ϊ���ɫ���������������Һ����Һ���� | ԭ��Һ����I-���� |
C | ����Ba(NO3)2��Һ�����ɰ�ɫ��������ϡ�����������ܽ�ʱ | ԭ��Һ���� |
D | ����ϡ���ᣬ���ɵ�������ʹ����ʯ��ˮ����� | ԭ��Һ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д���������ʵĽṹ��ʽ��
(1)2��3��������_________��
(2)2��3����1��ϩ____________��
��ϵͳ���������������л��
(3) ��___________
��___________
(4) ��___________
��___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�������������ォ��ˮ�е�����[CO(NH2)2]�Ļ�ѧ��ֱ��ת��Ϊ����,�����ɻ����Ѻ����ʵ�װ�ã�ͬʱ���ô�װ�õĵ��������϶�ͭ������˵�����������ǣ� ��
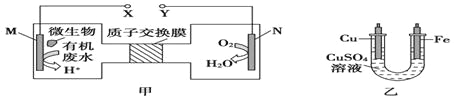
A.��װ������Һ��ɫ����
B.ͭ�缫Ӧ��Y������
C.M�缫��Ӧʽ��CO(NH2)2+H2O-6e-=CO2��+N2��+6H+
D.��N�缫����0.25mol����ʱ��ͭ�缫��������16g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֳƼ��ѣ����DME���۵㣭141.5 �棬�е㣭24.9 �棬��ʯ��Һ����(LPG)���ƣ�����Ϊ��21���͵����ȼ�������Ʊ�ԭ�����£�
��.����Ȼ�����Ʊ������ѣ�
��2CH4(g)��O2(g) =CH3OCH3(g)��H2O(g)����H1
��.�ɺϳ����Ʊ������ѣ�
��CO(g)��2H2(g) ![]() CH3OH(g) ��H2����90.7 kJ��mol��1
CH3OH(g) ��H2����90.7 kJ��mol��1
��2CH3OH(g) ![]() CH3OCH3(g)��H2O(g)����H3
CH3OCH3(g)��H2O(g)����H3
�ش��������⣺
(1)������Ͷ����ѵ�ȼ���ȷֱ���890.3 kJ��mol��1��1 453.0 kJ��mol��1��1 molҺ̬ˮ��Ϊ��̬ˮҪ����44.0 kJ����������Ӧ���е���صĻ�ѧ���������������
��ѧ�� | H��H | C��O | H��O(ˮ) | H��O(��) | C��H |
E (kJ �� mol��1) | 436 | 343 | 465 | 453 | 413 |
����H1��______kJ��mol��1����H3��______ kJ��mol��1
(2)��Ӧ�۵Ļ�ѧƽ�ⳣ������ʽΪ______________���Ʊ�ԭ�����У��ں��¡����ݵ��ܱ������кϳɣ������尴n(CH4)��n(O2)��2��1��ϣ�����ȷ��ӳ��Ӧ����CH4 ������������¶ȱ仯��������_________________�������ܱ�����Ӧ�ٴﵽ��ѧƽ��״̬����_______________��
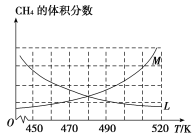
A�����������ܶȲ���
B����Ӧ�����ж����ѵİٷֺ�������
C����Ӧ��ķ�Ӧ������������ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮��
D����������ѹǿ����
(3)����ģ���Ʊ�ԭ������500 Kʱ��2 L���ܱ������г���2 mol CO��6 mol H2,8 min�ﵽƽ�⣬ƽ��ʱCO��ת����Ϊ80%��c(CH3OCH3)��0.3 mol��L��1����H2��ʾ��Ӧ�ڵ�������__________�����淴Ӧ�۵�ƽ�ⳣ��K3��_________������500 Kʱ�����������n(CH3OH)��n(CH3OCH3)����ʱ��Ӧ��v(��)_________v(��)��˵��ԭ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ���ǣ� ��
A. ��0.1 molL��1CH3COOH��Һ�м�������ˮ����Һ��c��H+��/c��CH3COOH����С
B. ��CH3COONa��Һ��20��������60�棬��Һ��c��CH3COO-��/[c��CH3COOH����c��OH-��]����
C. �������м��백ˮ�����ԣ���Һ��c��NH4+��/c��Cl-��>1
D. pH=4.5�ķ���֭��c��H+����pH=6.5��ţ����c��H+����100��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com