
【题目】严重的雾霾天气,给人们的出行及身体造成了极大的危害,研究NO2、SO2、CO等大气污染气体的形成及处理具有重要意义。
(1)500℃时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器甲和恒容容器乙中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO2的转化率关系是甲_____乙(填“>”、“<”或“=”)。
②在容器乙中,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,充入1molSO3 d.在其他条件不变时,改用高效催化剂
(2)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_______________。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显_____性(填“酸”、“碱”或“中”),用化学平衡原理解释:________。
(3)用CH4催化剂还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48CH4还原NO2至N2,整个过程中转移的电子总数为_____(阿伏加德罗常数的值用NA表示),放出的热量为_______kJ。
(4)工业上合成氨所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)====CO2(g)+H2(g) △H<0。一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6.则平衡常数K=______(计算结果保留两位小数)。
【答案】 > b 2OH-+SO2=SO32-+HO2 酸性 HSO3-存在HSO3-![]() H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O![]() H2SO3+OH-,HSO3-的电离程度大于水解程度 1.60NA(或1.6NA) 173.4 2.67
H2SO3+OH-,HSO3-的电离程度大于水解程度 1.60NA(或1.6NA) 173.4 2.67
【解析】试题分析:本题考查化学平衡常数的计算,外界条件对化学平衡的影响,反应热的计算,弱酸酸式盐溶液酸碱性的判断。
(1)①SO2发生催化氧化反应的方程式为2SO2+O2![]() 2SO3,该反应的正反应为气体分子数减小的反应,甲为恒压容器,建立平衡过程中容器的体积减小,甲相当于在乙达平衡后增大压强,增大压强平衡向正反应方向移动,反应物的转化率增大,两容器中SO2的转化率:甲
2SO3,该反应的正反应为气体分子数减小的反应,甲为恒压容器,建立平衡过程中容器的体积减小,甲相当于在乙达平衡后增大压强,增大压强平衡向正反应方向移动,反应物的转化率增大,两容器中SO2的转化率:甲![]() 乙。
乙。
② a项,温度和容器体积不变,充入1.0molHe,各物质的浓度不变,平衡不发生移动,SO2的转化率不变;b项,温度和容器体积不变,充入1.0molO2,增大O2的浓度,平衡向正反应方向移动,SO2的转化率增大;c项,在其他条件不变时,充入lmolSO3,增大SO3浓度,平衡向逆反应方向移动,SO2的转化率减小;d项,在其他条件不变时,改用高效催化剂,平衡不发生移动,SO2的转化率不变;能使SO2转化率提高的是b,答案选b。
(2)①SO2属于酸性氧化物,与NaOH反应生成Na2SO3和H2O,反应的化学方程式为SO2+2NaOH=Na2SO3+H2O,离子方程式为SO2+2OH-=SO32-+H2O。
②NaHSO3溶液中S元素主要以HSO3-形式存在,HSO3-微弱发生电离,n(HSO3-):n(SO32-)![]() 1:1,根据表中数据,NaHSO3溶液呈酸性。原因是:在NaHSO3溶液中既存在HSO3-的电离平衡HSO3-
1:1,根据表中数据,NaHSO3溶液呈酸性。原因是:在NaHSO3溶液中既存在HSO3-的电离平衡HSO3-![]() H++SO32-,又存在HSO3-的水解平衡HSO3-+H2O
H++SO32-,又存在HSO3-的水解平衡HSO3-+H2O![]() H2SO3+OH-,且HSO3-的电离程度大于水解程度,溶液呈酸性。
H2SO3+OH-,且HSO3-的电离程度大于水解程度,溶液呈酸性。
(3)将反应编号:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mo1-1(①式)
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1(②式)
应用盖斯定律,将(①式+②式)![]() 2得,CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)ΔH=(-574kJ/mol-1160kJ/mol)
2得,CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)ΔH=(-574kJ/mol-1160kJ/mol)![]() 2=-867kJ/mol,CH4还原NO2至N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)ΔH=-867kJ/mol,在该反应中C元素的化合价由CH4中的-4价升至CO2中的+4价,消耗1molCH4转移8mol电子,n(CH4)=
2=-867kJ/mol,CH4还原NO2至N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g)ΔH=-867kJ/mol,在该反应中C元素的化合价由CH4中的-4价升至CO2中的+4价,消耗1molCH4转移8mol电子,n(CH4)=![]() =0.2mol,标准状况下4.48LCH4反应转移1.6mol电子,转移电子数为1.6NA。放出的热量为867kJ/mol
=0.2mol,标准状况下4.48LCH4反应转移1.6mol电子,转移电子数为1.6NA。放出的热量为867kJ/mol![]() 0.2mol=173.4kJ。
0.2mol=173.4kJ。
(4)用三段式,设CO(g)、H2O(g)起始物质的量浓度依次为amol/L、2amol/L,从起始到平衡过程中转化CO物质的量浓度为xmol/L
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
c(起始)(mol/L) a 2a 0 0
c(转化)(mol/L) x x x x
c(平衡)(mol/L) a-x 2a-x x x
(a-x):(2a-x)=1:6,x=0.8a,平衡时CO、H2O(g)、CO2、H2物质的量浓度依次为0.2amol/L、1.2amol/L、0.8amol/L、0.8amol/L,平衡常数K=![]() =2.67。
=2.67。


科目:高中化学 来源: 题型:
【题目】科学家哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室制取氨气的化学方程式_________。检验氨气已装满的方法是________。
(2)氨气可用如图装置进行喷泉实验,把氨气换成______(填序号)也可形成喷泉实验。
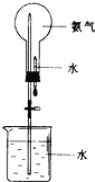
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气
(3)完成氨催化氧化生成为NO的反应方程式,4NH3+____O2===4NO+6_____,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:4NO+__O2+2H2O===4HNO3,___NO2+____O2 +__H2O===4HNO3
(4)12.8 g Cu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As的化合物在研究和生产中有许多重要用途。
(1)基态As原子的核外电子排布式为_________。
(2)N的第一电离能比O大,原因是______________。
(3)NH4+中H-N-H的键角比NH3中H-N-H 的键角_______(填“大”或“小”),原因是____________。
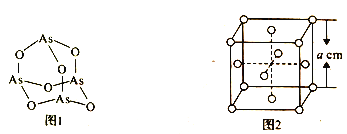
(4)K3AsO4中含有的化学键类型包括________;AsO43- 的空间构型为______。As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5 是_______晶体。
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2 (小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数的数值为NA,则该晶胞中含有P 原子的个数为______,该晶体的密度为_________(用含NA、a 的代数式表示) g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个圆所构成的元素概念的关系图,其中4为最大圆,3、2、1依次减小。试判断符合这种关系的是
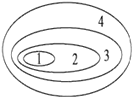
A. 1.最基本元素、2.基本元素、3.主要元素、4.大量元素
B. 1.大量元素、2.主要元素、3.基本元素、4.最基本元素
C. 1.基本元素、2.最基本元素、3.大量元素、4.主要元素
D. 1.主要元素、2.大量元素、3.最基本元素、4.基本元素
查看答案和解析>>
科目:高中化学 来源: 题型:
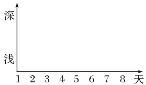
【题目】香蕉果实成熟过程中由于储存的物质变为可溶性糖从而使果实甜度增加。某兴趣小组对此生理变化进行了初步探究:取未成熟香蕉果实若干放在适宜条件下让其自然成熟,每天定时取10 g果肉研磨配制成100 mL待测样液平分为A、B两份,分别用碘液和斐林试剂检测,记录颜色深浅的变化。
(1)样液A用碘液检测的目的是__________________;样液B用斐林试剂检测的目的是___________。
(2)斐林试剂使用时需甲、乙液等量混合均匀后再注入,并____________观察颜色变化。
(3)根据预期结果在坐标图中画出两种颜色的变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实,完成相关的离子方程式或化学式,必要时可加一定文字说明:
(1)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂_____________________。
(2)泡沫灭火器的化学原理________________________________________________。
(3)热的纯碱溶液清洗油污___________________________________________。
(4)加热蒸干FeCl2水溶液并灼烧,得到物质的化学式为___________。
【答案】 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Al3++3HCO3-=Al(OH)3↓+3CO2↑ CO32-+H2O
Al(OH)3(胶体)+3H+ Al3++3HCO3-=Al(OH)3↓+3CO2↑ CO32-+H2O![]() HCO3-+OH-,加热可以促进水解,溶液碱性增强 Fe2O3
HCO3-+OH-,加热可以促进水解,溶液碱性增强 Fe2O3
【解析】(1)明矾净水的原理是氯离子水解得到氢氧化铝胶体,胶体吸附水中杂质,所以离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(2)泡沫灭火器中加入的是碳酸氢钠和硫酸铝,利用其双水解反应,离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑。
(3)热的纯碱溶液清洗油污是利用碳酸钠水解得到的碱与油污发生皂化反应,以除去油污,加热是为了促进碳酸根离子的水解,增强溶液的碱性。反应为:CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
(4)加热蒸干FeCl2水溶液并灼烧,氯化亚铁水解得到氢氧化亚铁和HCl,因为HCl挥发,所以水解平衡移动,得到的氢氧化亚铁被氧化为氢氧化铁,分解得到氧化铁。
【题型】填空题
【结束】
19
【题目】实验题
(一)实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:
(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的玻璃仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。

(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。滴定达到终点的标志是:_________。
(4)根据下列数据,烧碱的纯度为:_______________________(纯度=纯物质的质量/样品的质量×100%)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(二)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
<>①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)计算:血液中含钙离子的浓度为_____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,目前硫酸的主要生产方法是“接触法”,其主要反应之一为2SO2+O2![]() 2SO3。下列有关该反应的说法不正确的是( )
2SO3。下列有关该反应的说法不正确的是( )
A. SO2和O2不可能全部转化为SO3
B. 达到平衡后,反应就停止了,故正、逆反应速率相等且均为零
C. 该反应从开始到平衡的过程中,正反应速率不断减小,逆反应速率不断增大
D. 工业上生产SO3时,要同时考虑反应所能达到的限度和化学反应速率两个方面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com