
用NA表示阿伏伽德罗常数的值。下列判断正确的是
A. 常温常压下,22.4L Cl2含有的分子数目为NA
B. 18.0gH2O含有的氢原子数目为NA
C. 56.0gFe与足量Cl2完全反应时失去的电子数目为2NA
D. 1.0L 1.00mol·L—1Ca(NO3)2溶液中含有的NO3—离子数目为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 平衡时,若向容器①中再加入0.2molCO和0.2molCO2,则V正<V逆
C. Q=8.2
D. 容器①中CO的转化率与容器②中CO2的转化率之和为1
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期开学考试化学试卷(解析版) 题型:选择题
下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是( )

A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期开学考试化学试卷(解析版) 题型:选择题
下列实验操作简便、科学且易成功的是( )
A. 将乙酸和乙醇的混合液注入浓硫酸中制备乙酸乙酯
B. 将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色
C. 在试管中注入2 mL CuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀生成
D. 向苯酚溶液中滴加几滴稀溴水出现白色沉淀
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省镇江市高二年级学业水平测试(必修)化学试卷(解析版) 题型:选择题
下列有机反应方程式书写正确的是
A. 乙烯与溴的加成:CH2==CH2+Br2 CH3CHBr2
CH3CHBr2
B. 乙醇与乙酸的酯化:CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
C. 乙醇的催化氧化:CH3CH2OH+3O2 2CO2+3H2O
2CO2+3H2O
D. 苯的硝化:
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省镇江市高二年级学业水平测试(必修)化学试卷(解析版) 题型:选择题
工业上可用金属钠和四氯化钛反应制备金属钛,其化学方程式为:4Na+TiCl4 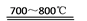 4NaCl+Ti。该反应属于
4NaCl+Ti。该反应属于
A. 置换反应 B. 复分解反应 C. 分解反应 D. 化合反应
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省镇江市高二年级学业水平测试(必修)化学试卷(解析版) 题型:选择题
下列过程主要属于化学变化的是
A. 铜器锈蚀 B. 碘的升华 C. 氨气液化 D. 石油分馏
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二下学期学前考试化学试卷(解析版) 题型:选择题
有关热化学方程式书写与对应表述均正确的是( )
A. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的标准燃烧热为110.5 kJ·mol-1
B. 在101KPa下氢气的标准燃烧热△H =-285.5 kJ·mol则水分解的热化学方程式: 2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 稀硫酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) △H = -57.3 kJ·mol-1
D. 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则Fe(s)+S(g)=FeS(s) △H= - 95.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2017届天津市红桥区高三上学期期末考试(下学期开学考试)化学试卷(解析版) 题型:简答题
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g) ===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:___。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)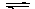 CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/ kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题
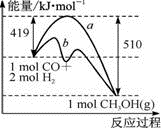
①该反应的ΔS____(填“>”或“<”)0。右图中曲线a到曲线b的措施是_______。
②已知CO中的C与O之间为三键,其键能为x kJ·mol-1,则x=____。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。①该电池负极的电极反应式为__。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl? | SO42 - |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。

(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2?,O2?穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com