
I、(10分)现有下列电解质溶液:① Na 2CO3 ② NaHCO3 ③苯酚钠(不与碱反应) ④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3 > 苯酚> HCO3-。常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH 7(填>、=或<), 理由是:
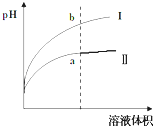
II、(4分)室温时,向a mL 0.10 mol/L的稀氨水中逐滴加入 b mL 0.10 mol/L的稀盐酸,试分析:
(1)当b=a时,溶液呈________(填“酸”“碱”或“中”)性,此时溶液中,c(NH)________(填“>”“<”或“=”)c(Cl-).
(2)当溶液呈中性时,a________(填“>”“<”或“=”)b,此时溶液中c(NH)________c(Cl-)(同上).
(14分)Ⅰ(10分)答案:(1)②④⑤ (2分)(漏选给1分,错选不给分)
(2)①>③>② (2分)
(3)2OH-+HCO3-+NH4+ CO32-+2H2O+NH3↑(2分)
CO32-+2H2O+NH3↑(2分)
(4) > (2分) 由题知,醋酸的酸性与NH3.H2O的碱性强弱相当,而碳酸酸性比醋酸弱,即碳酸的酸性比NH3.H2O的碱性弱,故NH4HCO3溶液显碱性(2分)
Ⅱ(共4分,每空1分)18、 (1) 酸 < (2) > =
【解析】
试题分析:Ⅰ(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是②④⑤。
(2)酸越弱,相应的钠盐越容易水解,则根据酸性强弱顺序可知,常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为①>③>②。
(3)碳酸氢铵与足量NaOH溶液混合加热反应的离子方程式是2OH-+HCO3-+NH4+ CO32-+2H2O+NH3↑。
CO32-+2H2O+NH3↑。
(4)常温下CH3COONH4溶液呈中性,这说明醋酸的酸性与NH3.H2O的碱性强弱相当,而碳酸酸性比醋酸弱,即碳酸的酸性比NH3.H2O的碱性弱,故NH4HCO3溶液显碱性。
II、(1)a=b,说明二者恰好反应生成氯化铵,氯化铵水解,溶液显酸性。根据电荷守恒可知c(NH)+c(H+)=c(OH-)+c(Cl-),所以c(NH)<c(Cl-)。
(2)当溶液呈中性时,说明氨水过量,因此a>b。根据电荷守恒可知c(NH)+c(H+)=c(OH-)+c(Cl-),所以c(NH)=c(Cl-)。
考点:考查离子方程式的书写、溶液酸碱性的判断以及溶液中离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和学习方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生的应试能力。该题的关键是利用好溶液中的几种守恒关系,即电荷守恒、物料守恒和质子守恒。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液查看答案和解析>>
科目:高中化学 来源:2012届北京市101中学高三上学期统考二化学试卷 题型:填空题
I. 现有下列8种物质
①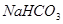 ;②
;②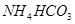 ;③
;③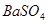 ;④HF;⑤
;④HF;⑤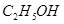 ;⑥
;⑥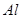 ;⑦食盐水;⑧
;⑦食盐水;⑧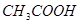
其中属于强电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟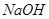 溶液反应的是_____________。
溶液反应的是_____________。
II. 现有一瓶浓度为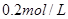 的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取
的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取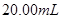 该酸
该酸 溶液,逐滴加入
溶液,逐滴加入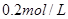 的氢氧化钠溶液,恰好反应完全时所需碱液体积为
的氢氧化钠溶液,恰好反应完全时所需碱液体积为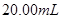 ,请用化学用语回答:
,请用化学用语回答:
(1)该酸不可能是____________;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为____________,用离子方程式说明溶液呈碱性的原因_________ _______________。
_______________。
III. A、B、C、D均为可溶于水的固体,组成它们的离子有:
| 阳离子 | 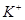 、 、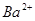 、 、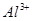 、 、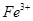 |
| 阴离子 | 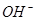 、 、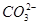 、 、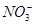 、 、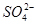 |
 如下:
如下:查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁瓦房店高级中学高二上学期期中考试化学试卷(带解析) 题型:填空题
(12分)下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I、属于非电解质的是 (填序号)Ⅱ、⑴NaHCO3是一种 (填“强”或“弱”)电解质;
⑵写出HCO3―水解的离子方程式: ;
⑶常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH―五种微粒的浓度由大到小的顺序为: 。
⑷常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
Ⅲ 、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
⑴溶液中由水电离出c(OH―)=______________;
⑵与某浓度盐酸溶液按体积比(碱与酸之比)1: 9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源:2014届辽宁瓦房店高级中学高二上学期期中考试化学试卷(解析版) 题型:填空题
(12分)下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I、属于非电解质的是 (填序号)Ⅱ、⑴NaHCO3是一种 (填“强”或“弱”)电解质;
⑵写出HCO3―水解的离子方程式: ;
⑶常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH― 五种微粒的浓度由大到小的顺序为: 。
⑷常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知:10-5.60=2.5×10-6)
Ⅲ 、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
⑴溶液中由水电离出c(OH―)=______________;
⑵与某浓度盐酸溶液按体积比(碱与酸之比)1: 9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com