
【化学——选修5:有机化学基础】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等.某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
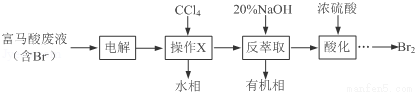
(1)操作X所需要的主要玻璃仪器为____________;反萃取时加入20%的NaOH溶液,其离子方程式为________________________.
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是_________.
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出.与传统工艺相比,萃取法的优点是____________________________.
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
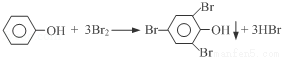
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中.
步骤2:将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡.
步骤4:____________________________,再用0.01mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL.(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
步骤5:将实验步骤1~4重复2次.
②该废水中苯酚的含量为____________mg/L.
③步骤3若持续时间较长,则测得的废水中苯酚的含量_________________(填“偏高”、“偏低”或“无影响”).
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:选择题
已知某酸性溶液中含有Ba2+、Fe3+,则下列能与上述离子共存的离子组是( )
A. CO32﹣、SO42﹣、NH4+、Na+ B. Cl﹣、SCN﹣、NO3﹣、Cu2+
C. Br﹣、I﹣、Mg2+、Na+ D. H+、Cl﹣、NO3﹣、Al3+
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
由二氧化硅制高纯硅的流程如下,下列判断中错误的是

A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:选择题
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为

A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 酯类物质是形成水果香味的主要成分
B. 可用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C. 乙酸乙酯、油脂与烧碱溶液反应均有醇生成
D. 可向蔗糖的水解液中直接加入银氨溶液检验蔗糖是否发生水解
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三2月月考理科综合化学试卷(解析版) 题型:选择题
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高二上学期期末学分认定考试B卷化学试卷(解析版) 题型:简答题
酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是_____________(填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是___________(填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

① 滴定醋酸的曲线是____________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________________。
③ V1和V2的关系:V1___________V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___________________。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)=_____mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较________(填溶质的化学式)溶液中NH 的浓度更大,其原因是__________________
的浓度更大,其原因是__________________
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高二上学期期末学分认定考试B卷化学试卷(解析版) 题型:选择题
下列关于能源和作为能源的物质叙述错误的是( )
A. 化石能源物质内部蕴涵着大量的能量
B. 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C. 吸热反应是反应物总能量大于生成物的总能量
D. 物质的化学能可以在不同的条件下转化为热能、电能被人类利用
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一下学期开学检测化学试卷(解析版) 题型:计算题
一块表面已部分氧化(氧化层为Na2O)的金属钠样品质量为0.77g,放入100mL水中后,得到标准状况下氢气的体积224mL,该金属钠样品中含金属钠__________克,所得溶液溶质的物质的量浓度约为 ________________。(设所得溶液的体积仍为100mL)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com