
����Ŀ��ij��ѧС��ͬѧ̽����ʵ������![]() ����ĸ������ء�
����ĸ������ء�
(1)������Һ���Ƿ���![]() ʱ���ù������Ὣ��Һ�ữ����Ŀ�����ų�_______________��
ʱ���ù������Ὣ��Һ�ữ����Ŀ�����ų�_______________��![]() ��Ag+�����ӿ�����ɵĸ��š�
��Ag+�����ӿ�����ɵĸ��š�
(2)Ϊ����֤�����ܷ��ų�![]() �ĸ��ţ���С��ͬѧ����������ʵ�飺
�ĸ��ţ���С��ͬѧ����������ʵ�飺
������ȡһ�������Ũ����(ʢ��Ũ�����Լ�ƿ�ı�ǩ�в�����Ϣ����ͼ)��ϡ�ͣ����Ƴ� 5 mol/L ��ϡ���ᡣ

��ͬѧȡ 0.3 g δ���ʵ� Na2SO3 ���壬�����м������� 5mol/L ϡ�����������������������ݡ������μ� 4 ��BaCl2 ��Һ��Ѹ�ٲ�����ɫ���ǣ�������ɫ���ǵ�ԭ������ǣ�
��______________��
�������к��� Fe3+��ʵ��֤ʵ���� Fe3+�ķ����ǣ�___________________�������ӷ���ʽ������ Fe3+������ɫ���ǵ�ԭ��__________��
(3)��ͬѧ���������![]() ʱ�ܷ��������ữ���ų�
ʱ�ܷ��������ữ���ų�![]() �ĸ��ţ���ͬѧ��Ϊ�����У�������(�����ӷ���ʽ��ʾ)____________________________������ʵ�飺��ȡ 5 �� 0.3 g δ���ʵ�Na2SO3 ���壬�ֱ������м��� 10 mL ��ͬŨ�ȵ����ᣬ ���ٵμ� 4 ��BaCl2 ��Һ���۲첢��¼ʵ���������±���
�ĸ��ţ���ͬѧ��Ϊ�����У�������(�����ӷ���ʽ��ʾ)____________________________������ʵ�飺��ȡ 5 �� 0.3 g δ���ʵ�Na2SO3 ���壬�ֱ������м��� 10 mL ��ͬŨ�ȵ����ᣬ ���ٵμ� 4 ��BaCl2 ��Һ���۲첢��¼ʵ���������±���
����Ũ��(mol/L) | �μ��Ȼ�����Һ֮ǰ���� | �μ��Ȼ�����Һ֮������ |
15.0(Ũ����) | ������������ɫ���壬��Һ�ʻ�ɫ | ��������������ɫ���� |
7.5 | ������������ɫ���壬��Һ�ʵ���ɫ | ��������������ɫ���� |
4.8 | ����������ɫ���̼�����ζ���壬��Һ��ɫ | ��ʼ������Լ 60 min ����Һ��ʼ����� |
2.0 | ����������ɫ���̼�����ζ���壬��Һ��ɫ | ��ʼ������Լ 70 min ����Һ��ʼ����� |
0.5 | ����������ɫ���̼�����ζ���壬��Һ��ɫ | ��ʼ������Լ 120 min ����Һ��ʼ����� |
��������ʵ��ó��Ľ����ǣ�________________��
(4)��ͬѧ�������Ϻ������Cl-�Ĵ���Ҳ���![]() �ļ���������š��� Cl-�������£�ϡ����ɽ�
�ļ���������š��� Cl-�������£�ϡ����ɽ�![]() ����Ϊ
����Ϊ ![]() ��Ϊ֤�������۵㣬�������ʵ�飬�뽫ʵ�颢�IJ�������������
��Ϊ֤�������۵㣬�������ʵ�飬�뽫ʵ�颢�IJ�������������
ʵ�� | ʵ����� | ʵ������ |
�� | �� 0.3 g Na2SO3 �� 0.3 g NaCl �����ϣ����� 10 mL 2.0mol/L ��ϡ���ᣬ���ٵμ� 4 �� BaCl2 ��Һ�� | ��������������ɫ������ |
�� | ____________�� | ������Сʱ����Һδ����ǡ� |
���𰸡�![]() �����в����������ȣ���������
�����в����������ȣ���������![]() ������
������![]() ȡ�����������Թ��У��μ�KSCN ��Һ����Һ��� 2Fe3++
ȡ�����������Թ��У��μ�KSCN ��Һ����Һ��� 2Fe3++![]() +H2O=
+H2O=![]() +2Fe2++2H+ ��Ba2++
+2Fe2++2H+ ��Ba2++![]() =BaSO4�� 3
=BaSO4�� 3![]() + 2
+ 2![]() + 2H+��3
+ 2H+��3![]() + 2NO��+ H2O ��
+ 2NO��+ H2O ��![]() + 2
+ 2![]() + 2H+��
+ 2H+��![]() + 2NO2��+ H2O ʵ���Ҽ���
+ 2NO2��+ H2O ʵ���Ҽ���![]() ʱ���� 0.5~4.8 mol/L �������ữ�����ų�
ʱ���� 0.5~4.8 mol/L �������ữ�����ų� ![]() �ĸ��� �� 0.3 g Na2SO3 �����м��� 10 mL 2.0 mol/L ��ϡ���ᣬ���ٵμ� 4 ��Ba(NO3)2��Һ
�ĸ��� �� 0.3 g Na2SO3 �����м��� 10 mL 2.0 mol/L ��ϡ���ᣬ���ٵμ� 4 ��Ba(NO3)2��Һ
��������
����![]() ʱ��ͨ������Ba2+����ͬʱ���ֹijЩ���ӵ�ֱ�Ӹ��ţ���
ʱ��ͨ������Ba2+����ͬʱ���ֹijЩ���ӵ�ֱ�Ӹ��ţ���![]() ��
��![]() �ȣ������ֹijЩ���ӵļ�Ӹ��ţ���
�ȣ������ֹijЩ���ӵļ�Ӹ��ţ���![]() ��Fe3+�ȣ���ôHNO3����Ũ����Σ��Ƿ��ܽ�
��Fe3+�ȣ���ôHNO3����Ũ����Σ��Ƿ��ܽ�![]() ����Ϊ
����Ϊ![]() �����Ʋ���ɵ�Cl-�Ƿ�Ҳ��Ӱ��
�����Ʋ���ɵ�Cl-�Ƿ�Ҳ��Ӱ��![]() �ļ��飬ͨ����ʵ�����ķ��������ǿɵó����ۡ�
�ļ��飬ͨ����ʵ�����ķ��������ǿɵó����ۡ�
(1)����![]() ʱ��������Ba2+������Һ�м�����Ba2+��Ӧ���������ᷴӦ�����ӣ������
ʱ��������Ba2+������Һ�м�����Ba2+��Ӧ���������ᷴӦ�����ӣ������![]() �ļ��飬�������ù������Ὣ��Һ�ữ����Ŀ�����ų�
�ļ��飬�������ù������Ὣ��Һ�ữ����Ŀ�����ų�![]() ��
��![]() ��Ag+�����ӿ�����ɵĸ��š���Ϊ��
��Ag+�����ӿ�����ɵĸ��š���Ϊ��![]() ��
��
(2) ��ͬѧȡ 0.3 g δ���ʵ� Na2SO3 ���壬�����м������� 5mol/L ϡ�����������������������ݡ������μ� 4 ��BaCl2 ��Һ��Ѹ�ٲ�����ɫ���ǡ�
�ӱ�ǩ��Ϣ�п��Կ�����Ũ�����к���Cl2��Fe3+�����Ƕ����������ԡ����Կ���ԭ���ǣ�
�������в����������ȣ���������![]() ������
������![]() ��
��
�������к��� Fe3+������KSCN��Һ֤ʵ���Ӷ��ó�֤ʵ���� Fe3+�ķ����ǣ�ȡ�����������Թ��У��μ�KSCN ��Һ����Һ��졣�����ӷ���ʽ������ Fe3+������ɫ���ǵ�ԭ��2Fe3++![]() +H2O=
+H2O=![]() +2Fe2++2H+ ��Ba2++
+2Fe2++2H+ ��Ba2++![]() =BaSO4������Ϊ�������в����������ȣ���������
=BaSO4������Ϊ�������в����������ȣ���������![]() ������
������![]() ��ȡ�����������Թ��У��μ�KSCN ��Һ����Һ��죻2Fe3++
��ȡ�����������Թ��У��μ�KSCN ��Һ����Һ��죻2Fe3++![]() +H2O=
+H2O=![]() +2Fe2++2H+ ��Ba2++
+2Fe2++2H+ ��Ba2++![]() =BaSO4����
=BaSO4����
(3)��ͬѧ���������![]() ʱ�ܷ��������ữ���ų�
ʱ�ܷ��������ữ���ų�![]() �ĸ��ţ���ͬѧ��Ϊ�����ܽ�
�ĸ��ţ���ͬѧ��Ϊ�����ܽ�![]() ���������Բ����У�������3
���������Բ����У�������3![]() + 2
+ 2![]() + 2H+��3
+ 2H+��3![]() + 2NO��+ H2O ��
+ 2NO��+ H2O ��![]() + 2
+ 2![]() + 2H+��
+ 2H+��![]() + 2NO2��+ H2O������ʵ�飺�ӱ������ݼ�������Կ������������Ũ�ȴ���4.8mol/Lʱ���ܽ�
+ 2NO2��+ H2O������ʵ�飺�ӱ������ݼ�������Կ������������Ũ�ȴ���4.8mol/Lʱ���ܽ�![]() Ѹ���������������Ũ��С��4.8mol/Lʱ�����ѽ�
Ѹ���������������Ũ��С��4.8mol/Lʱ�����ѽ�![]() ����������ʵ��ó��Ľ����ǣ�ʵ���Ҽ���
����������ʵ��ó��Ľ����ǣ�ʵ���Ҽ���![]() ʱ���� 0.5~4.8 mol/L �������ữ�����ų�
ʱ���� 0.5~4.8 mol/L �������ữ�����ų� ![]() �ĸ��š���Ϊ��3
�ĸ��š���Ϊ��3![]() + 2
+ 2![]() + 2H+��3
+ 2H+��3![]() + 2NO��+ H2O ��
+ 2NO��+ H2O ��![]() + 2
+ 2![]() + 2H+��
+ 2H+��![]() + 2NO2��+ H2O��ʵ���Ҽ���
+ 2NO2��+ H2O��ʵ���Ҽ���![]() ʱ���� 0.5~4.8 mol/L �������ữ�����ų�
ʱ���� 0.5~4.8 mol/L �������ữ�����ų� ![]() �ĸ��ţ�
�ĸ��ţ�
(4)��ͬѧ�������Ϻ������Cl-�Ĵ���Ҳ���![]() �ļ���������š��� Cl-�������£�ϡ����ɽ�
�ļ���������š��� Cl-�������£�ϡ����ɽ�![]() ����Ϊ
����Ϊ![]() ��Ϊ֤�������۵㣬����������Ա�ʵ�飬һ������Cl-��һ��������Cl-���Ӷ��ó�ʵ�����IJ���Ϊ���� 0.3 g Na2SO3 �����м��� 10 mL 2.0 mol/L ��ϡ���ᣬ���ٵμ� 4 ��Ba(NO3)2��Һ����Ϊ���� 0.3 g Na2SO3 �����м��� 10 mL 2.0 mol/L ��ϡ���ᣬ���ٵμ� 4 ��Ba(NO3)2��Һ��
��Ϊ֤�������۵㣬����������Ա�ʵ�飬һ������Cl-��һ��������Cl-���Ӷ��ó�ʵ�����IJ���Ϊ���� 0.3 g Na2SO3 �����м��� 10 mL 2.0 mol/L ��ϡ���ᣬ���ٵμ� 4 ��Ba(NO3)2��Һ����Ϊ���� 0.3 g Na2SO3 �����м��� 10 mL 2.0 mol/L ��ϡ���ᣬ���ٵμ� 4 ��Ba(NO3)2��Һ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɲⶨ�к��ȡ����й��ڸ�ʵ���˵����ȷ����

A.��ʵ��װ�ÿ�����Ͳδ��������ͼ�л�ȱ��һ����Ҫ������
B.����һ���������к��Ȳⶨʵ�飬�¶ȼ���Ҫʹ��2��
C.�ձ������ֽм�������ǹ̶��ձ���λ��
D.����ʵ���������������ɢʧ�����Բ�õ��к��ȡ�H������ֵҪС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ���ѻ����ѽ���̵õ���CH2=CH2����һ�������¿��Ծۺϳɸ߷��ӻ��������![]() �ṹ�Ļ�������CH2=CH2һ��������һ�������¾ۺϳɸ߷��ӻ����
�ṹ�Ļ�������CH2=CH2һ��������һ�������¾ۺϳɸ߷��ӻ����
(1)�㷺����ũ�ñ�Ĥ�ľ�����ϩ���ϣ�����![]() �ۺϳɵģ��仯ѧ����ʽ��____________��
�ۺϳɵģ��仯ѧ����ʽ��____________��
(2)������װ�д���ʹ�õ���ĭ���ϵ���Ҫ�ɷ��Ǿ۱���ϩ(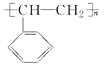 )��������________________(д�ṹ��ʽ)�ۺ϶��ɵġ�
)��������________________(д�ṹ��ʽ)�ۺ϶��ɵġ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�Ӧ�������ں��Ӹֹ죬���һ�������ұ���۵�ϸߵĽ����緰�������̵ȡ�
����ƽ���������ȷ�Ӧұ�����������ܵĻ�ѧ����ʽ��ָ����Щ�����ǻ�ԭ������Щ������������������������1 mol���ֽ����ֱ���Ҫ������������
V2O5+Al����Al2O3+V Co3O4+Al����Al2O3+Co
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ַdz���Ҫ�Ļ���ԭ�ϣ���ҵ��CO2 ��������ȼ�ϼ״������ܻ�������ЧӦ��ҲΪ�״��ĺϳ�Ѱ������������
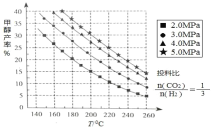
(1)�״��ĺϳɣ��ϳɼ״��ķ�ӦΪ��CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H ���ڴ��������£���ü״��IJ����뷴Ӧ�¶ȡ�ѹǿ��ϵ����ͼ��ʾ�� ��ͼ�����ݿ�֪����H______0(ѡ ��������������������)���״���������ѹǿ�仯����ͼʾ���ɵ�ԭ����_______��
(2)�״���Ӧ�ã���Ȳ�������һ����Ҫ���л�����ԭ�ϣ�������ˮ�����³�Һ̬���е�Ϊ 103~105 �档ʵ���ҿ��ü״�����һ�л�ԭ�� M ��һ���������Ʊ���ʵ�鲽�����£�
���� 1���ڷ�Ӧƿ�У����� 13 g ԭ�� M��50 mL �״��� 2 mL Ũ���ᣬ���裬���Ȼ���һ��ʱ�䡣
���� 2�����������ļ״�(װ�ü���ͼ)��
���� 3����ӦҺ��ȴ�������ñ��� NaCl ��Һ�� 5%Na2CO3 ��Һ��ˮϴ�ӣ�������л��ࡣ
���� 4���л��ྭ��ˮ Na2SO4 ������ˡ����� �ñ�Ȳ�������
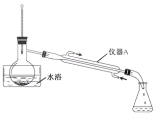
�ٲ��� 1 �з�Ӧ�Ļ�ѧ����ʽ��_____________��
�ڲ��� 1 �У���������״���Ŀ����_____________��
�۲��� 3 �� Na2CO3 ��Һϴ����Ҫȥ����������______���ò����в��õ�����Ũ�ȵ�NaOH ��Һ����Na2CO3 ��Һϴ����Ҫԭ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ⰱ���������������װ����ͼ��ʾ������˵���������
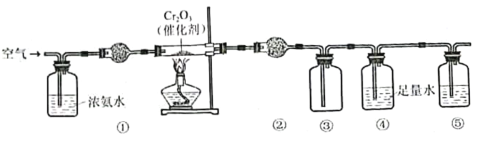
A.װ�â١��ڡ�������ʢװ��ʯ�ҡ�P2O5��NaOH��Һ
B.װ�â��в�������ɫ����
C.װ�â�����Һ��ʹ��ɫʯ����Һ��죬˵����HNO3����
D.ͨ��������Ҫ�����ǹij���������������N2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��B����ȴװ��δ���������������Ϳ����������뷴Ӧ���������Լ1:3���ͨ�뺬ˮ8%��̼�������Ʊ�Cl2O������ˮ����Cl2O�Ʊ���������Һ��
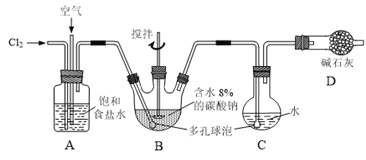
��֪��Cl2O��������ˮ����ˮ��Ӧ����HClO��Cl2O�ķе�Ϊ3.8����42�����Ϸֽ�ΪCl2��O2��
��1����ʵ���п����������������ȵķ�����______��
��Ϊʹ��Ӧ��ֽ��У�ʵ���в�ȡ�Ĵ�ʩ��______��
��2����д��װ��B�в���Cl2O�Ļ�ѧ����ʽ���õ����ŷ��������ת�Ƶķ������Ŀ��______��
����B����ȴװ�ã������C�е�Cl2O��������١���ԭ����______��
��3��װ��C�в�����ɫԲ����ƿ����Ϊ______��
��4����֪������ɱ�H2O2��FeCl2�����ʻ�ԭ��Cl�����ⶨC�д�������Һ�����ʵ���Ũ�ȵ�ʵ�鷽��Ϊ������ʽ�ζ���ȷ��ȡ20.00 mL��������Һ��______������ѡ�õ��Լ���H2O2��Һ��FeCl2��Һ��AgNO3��Һ����������������ʹ�õ������У�������ƽ����ո����䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʼ�¶�Ϊt �����������ܱյ������а���ͬ��ʽͶ�뷴Ӧ��������·�Ӧ��4HCl(g)��O2(g)![]() 2Cl2(g)��2H2O(g) ��H����116kJ��mol��1����÷�Ӧ������������£�
2Cl2(g)��2H2O(g) ��H����116kJ��mol��1����÷�Ӧ������������£�
���� | �������� | ��ʼ��� | ��ʼѹǿ/Pa | ��Ӧ��Ͷ����/mol | ƽ��ʱCl2�����ʵ���/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | ���º��� | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | ���Ⱥ��� | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | ���º�ѹ | 2L | p3 | 8 | 2 | 0 | 0 | b |
����˵����ȷ����(����)
A.��Ӧ4HCl(g)��O2(g)![]() 2Cl2(g)��2H2O(l)����H>��116 kJ��mol��1
2Cl2(g)��2H2O(l)����H>��116 kJ��mol��1
B.a��1, b��2
C.p2��1.6��105Pa��p3��4��105Pa
D.����ʼ���������г���0.5 mol HCl��0.5 mol O2��0.5 mol Cl2��0.5 mol H2O����Ӧ���淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com