
(12分)黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]:测定硫元素的含量
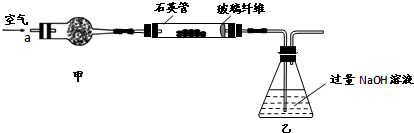
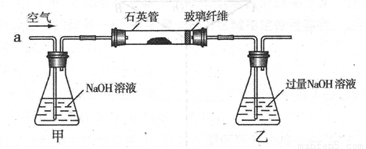
将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。
写出石英管中发生反应的化学方程式为:
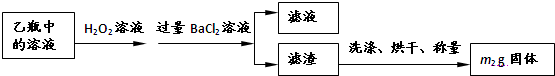
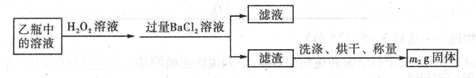
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)I中,甲瓶内所盛试剂是____________溶液。乙瓶内发生反应的离子方程式有___________________ _____、___________________ _____。
(2)Ⅱ中,所加H2O2溶液需足量的理由是_________________ ______。
(3)该黄铁矿石中硫元素的质量分数为____________________________ 。
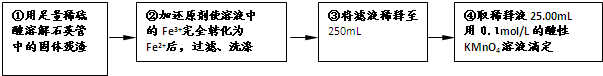
[实验二]:设计以下实验方案测定铁元素的含量
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗? 。
若不合理,会如何影响测量结果:_______________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_____ ___。
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.42 | 25.05 | 24.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| ||
| ||
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 28V |
| m1 |
| 28V |
| m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:实验题
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
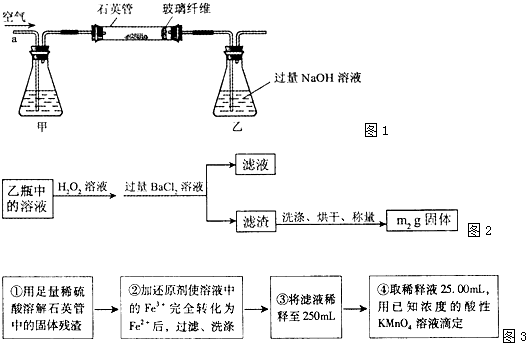
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2  2Fe2O3
+ 8SO2
2Fe2O3
+ 8SO2
II反应结束后,将乙瓶中的溶液进行如下处理
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
查看答案和解析>>
科目:高中化学 来源:2010年陕西省五校高三第一次模拟考试理综化学试题 题型:综合题
(14分)黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS)进行如下实验探究。
[实验一]:测定硫元素的含量
I.将mg该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有________________________、________________________________。
(2)Ⅱ中。所加HO溶液需足量的理由是________________。
(3)该黄铁矿石中硫元素的质量分数为________________。
[实验二]:设计以下实验方案测定铁元素的含量

问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗? ________。若不合理,会如何影响测量结果:________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(6)④中高锰酸钾溶液应放在_____滴定管中;判断滴定终点的现象为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com