
 铅蓄电池的工作原理为Pb + PbO2 + 4H+ + 2SO42- == 2PbSO4 + 2H2O。如下图所示,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极。先闭合K1足够长时间后断开K1。下列有关说法中不正确的是 ( ) ( )
铅蓄电池的工作原理为Pb + PbO2 + 4H+ + 2SO42- == 2PbSO4 + 2H2O。如下图所示,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极。先闭合K1足够长时间后断开K1。下列有关说法中不正确的是 ( ) ( )
A.1mol Pb和1mol PbO2具有的总能量大于2mol PbSO4具有的总能量
B.若将两U形管中的溶液混合,混合液的质量分数仍为30%
C.两U型管均可单独作为原电池使用,正极分别为A和F
D.若再单独闭合K2,电极A、B的质量会逐渐增加,电极E、F的质量会逐渐减小
【答案】A
【解析】能自发进行的氧化还原反应可设计成原电池,由此可知反应Pb + PbO2 + 4H+ + 2SO42- == 2PbSO4 + 2H2O属于放热反应,即1mol Pb、1mol PbO2和2molH2SO4具有的总能量大于2mol PbSO4和2molH2O具有的总能量,故A错。当先闭合K1,左侧U形管相当于原电池,电池反应式为Pb + PbO2 +2H2SO4 == 2PbSO4 + 2H2O,右侧装置相当于电解装置,电解时总反应式为2H2O![]() 2H2↑+O2↑,由于两装置转移的电子数相等,故选项B正确。对于选项C,左侧U形管作为原电池没有问题,而电解一段时间后右侧装置可看作形成氢氧燃料电池,由于F极产生O2,故也作正作,C正确。对于选项D,两装置相当串联电解,根据铅蓄电池的工作原理可知选项D正确。
2H2↑+O2↑,由于两装置转移的电子数相等,故选项B正确。对于选项C,左侧U形管作为原电池没有问题,而电解一段时间后右侧装置可看作形成氢氧燃料电池,由于F极产生O2,故也作正作,C正确。对于选项D,两装置相当串联电解,根据铅蓄电池的工作原理可知选项D正确。
【考点】电化学基础——二次电池的工作原理


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三上学期期末考试化学试卷 题型:选择题
铅蓄电池的工作原理为Pb + PbO2 + 4H+ + 2SO42- == 2PbSO4 + 2H2O。研读上图,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极。先闭合K1足够长时间后断开K1。下列有关说法中不正确的是:
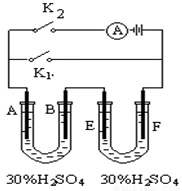
A.1mol Pb和1mol PbO2具有的总能量大于2mol PbSO4具有的总能量
B.若将两U形管中的溶液混合,混合液的质量分数仍为30%
C.两U型管均可单独作为原电池使用,正极分别为A和F
D.若再单独闭合K2,电极A、B的质量会逐渐增加,电极E、F的质量会逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com