分析:A、B、C、D、E、F均为前四周期元素.B元素的最外层电子数是其电子层数的3倍,B原子只能有2个电子层,最外层电子数为6,则B为O元素;C元素原子的M电子层的P亚层中有3个未成对电子,则其原子核外电子排布为1s
22s
22p
63s
23p
3,故C为P元素;D元素原子核外的M层中只有2对成对电子,则其原子核外电子排布为1s
22s
22p
63s
23p
4,故D为S元素;B离子与E离子具有相同的电子层结构,核外电子数为10,可形成E
2B
2、E
2B型化合物,则E为Na;F元素位于元素周期表的ds区,其原子与E原子具有相同的最外层电子数,则F为Cu;
(1)根据能量最低原理书写Cu原子核外电子排布;
(2)根据最后电子填充的能级确定其在周期表中的区域;
(3)A元素的原子价电子排布为ns
2np
2,当n=2时,A是C元素,与氢元素形成的相对分子质量为26的分子为乙炔;
(4)A元素的原子价电子排布为ns
2np
2,当n=3时,A是Si元素,硅和氧形成的晶体是二氧化硅晶体,属于原子晶体;Si晶体中每个Si原子与另外4个Si原子形成正四面体结构,每个Si-Si键为Si原子提供
,根据均摊法计算Si原子所处共价键数目,据此解答;
(5)AB
n型分子A原子孤对电子数=
(a-xb),a为A原子价电子数目,x为A原子结合原子数,b为B原子最多结合电子数目;
S原子价层电子对数=σ数+孤对电子数,结合S原子的孤对电子,确定SCl
2分子的空间构型;
(6)根据均摊法计算晶胞中Cu原子、O原子数目,据此确定化学式;
(7)相同能层电子能量相差不大,不能能层电子能量相差较大,故失去不同能层电子时电离能会发生突跃,由表中数据可知,失去第6个电子时,电离能剧增,故该元素最外层电子数为5.
解答:解:A、B、C、D、E、F均为前四周期元素.B元素的最外层电子数是其电子层数的3倍,B原子只能有2个电子层,最外层电子数为6,则B为O元素;C元素原子的M电子层的P亚层中有3个未成对电子,则其原子核外电子排布为1s
22s
22p
63s
23p
3,故C为P元素;D元素原子核外的M层中只有2对成对电子,则其原子核外电子排布为1s
22s
22p
63s
23p
4,故D为S元素;B离子与E离子具有相同的电子层结构,核外电子数为10,可形成E
2B
2、E
2B型化合物,则E为Na;F元素位于元素周期表的ds区,其原子与E原子具有相同的最外层电子数,则F为Cu;
(1)①由上述分析可知,B为氧元素;
②F为Cu原子,核外电子数为29,根据能量最低原理,核外的价电子排布为3d
104s
1,
故答案为:氧;3d
104s
1;
(2)①D为S元素,外围电子排布为3s
23p
4,电子最后填充p能级,属于p区元素,
②E为Na元素,外围电子排布式为3s
1,电子最后填充s能级,属于s区元素,
故答案为:p;s;
(3)A元素的原子价电子排布为ns
2np
2,当n=2时,A是C元素,与氢元素形成的相对分子质量为26的分子为乙炔,其结构式为H-C≡C-H,属于直线型对称结构,分子中正负电荷重心重合,为非极性分子,乙炔分子中C-H单键为个σ键,-C≡C-三键含有1个σ键、2个π键,故乙炔分子中共含有3σ键、2个π键,
故答案为:非极性;3;2;
(4)A元素的原子价电子排布为ns
2np
2,当n=3时,A是Si元素,硅和氧形成的晶体是二氧化硅晶体,属于原子晶体;Si晶体中每个Si原子与另外4个Si原子形成正四面体结构,Si原子成4个σ键、不含孤对电子,采取sp
3杂化,每个Si-Si键为Si原子提供
,即每个Si原子成共价键数目为4×
=2,故硅晶体中Si原子与Si-Si键数目之比=1:2,
故答案为:原子;sp
3;1:2;
(5)SCl
2分子中,中心原子S含有孤对电子对数=
=2,SCl
2分子中S原子价层电子对数=2+2=4,故其空间构型为V形,
故答案为:2;V;
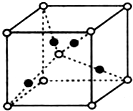
(6)由晶胞结构可知,晶胞中Cu原子数目=4、O原子数目=1+8×
=2,故该氧化物的化学式为Cu
2O,
故答案为:Cu
2O;
(7)相同能层电子能量相差不大,不能能层电子能量相差较大,故失去不同能层电子时电离能会发生突跃,由表中数据可知,失去第6个电子时,电离能剧增,故该元素最外层电子数为5,可能为上述P元素,
故答案为:P.
点评:本题考查物质结构与性质,题目比较综合,涉及结构性质位置关系、核外电子排布、分子结构与性质、价层电子对互斥理论、杂化理论、化学键、电离能、晶胞计算等,侧重考查主干知识,需要学生具备扎实的基础知识,难度中等,(4)为易错点、难点,注意识记中学常见晶体结构.

 【化学一选修3物质结构与性质】
【化学一选修3物质结构与性质】

 名校课堂系列答案
名校课堂系列答案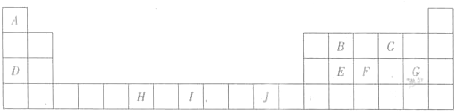
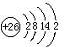
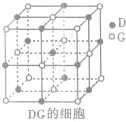 (3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的
(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的
 生成,则
生成,则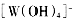 中存在________(填选项字母)
中存在________(填选项字母)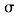 键 e. п键
键 e. п键