
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
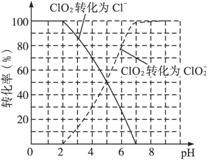
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(![]() )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中![]() 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
饮用水中ClO2、![]() 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为![]() 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,![]() 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时,![]() 与I-反应的离子方程式___________________________________。
与I-反应的离子方程式___________________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中![]() 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中![]() 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将![]() 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
(1)方法二制备的ClO2中不含Cl2
(2)①![]() +4H++4I-Cl-+2I2+2H2O
+4H++4I-Cl-+2I2+2H2O
②调节溶液的pH≤2.0
③![]()
④Fe(OH)3
解析:(1)分析问题时要了解有关知识。题干中明确指出用ClO2代替Cl2的优点,所以方法二优于方法一。
(2)①pH≤2.0,为酸性溶液,书写离子方程式时H+一定作为反应物。
②解答本题要弄清题意,前面在pH=7.0~8.0时,发生反应2ClO2+2I-====![]() +I2,则后面要在pH≤2.0情况下实现转化
+I2,则后面要在pH≤2.0情况下实现转化![]() →Cl-,以便测定ClO2、
→Cl-,以便测定ClO2、![]() 的含量,所以步骤⑤为调节溶液pH≤2.0。
的含量,所以步骤⑤为调节溶液pH≤2.0。
③pH=7.0~8.0,发生反应2ClO2+2I-====![]() +I2
+I2
关系式:
2ClO2~I2 ~ 2Na2S2O3 ~ 2![]()
c·V1·10-3 molc·V1·10-3 molc·V1·10-3 mol
pH≤2.0,发生变化![]() +4I-+4H+====Cl-+2I2+2H2O
+4I-+4H+====Cl-+2I2+2H2O
关系式:
![]() ~ 2I2~ 4Na2S2O3
~ 2I2~ 4Na2S2O3
![]() c·V2·10-3 mol
c·V2·10-3 mol
则c(![]() )=
)=



科目:高中化学 来源: 题型:
A.ClO2是强氧化剂
B.ClO2是强还原剂
C.ClO2是离子化合物
D.ClO2分子中氯为-1价
查看答案和解析>>
科目:高中化学 来源: 题型:
世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。下列说法正确的是( )
A.二氧化氯是强氧化剂 B.二氧化氯是强还原剂
C.二氧化氯是离子化合物 D.二氧化氯分子中氯为-1价
查看答案和解析>>
科目:高中化学 来源: 题型:
用氯气消毒的饮用水,会使水中的有机物发生氯化反应,生成有机含氯化合物,对人体有害,世界环保联盟建议推广采用高效氧化剂二氧化氯(ClO2)消毒。
(1)使用ClO2作饮用水消毒剂的优点是_____________________________。
(2)目前国外多用NaClO3与浓HCl反应制取ClO2,同时有Cl2生成,且体积为ClO2的一半,写出反应的化学方程式。__________________________________________________
(3)上述反应中产生0.1 mol Cl2,转移的电子的物质的量为_________ mol。
(4)在H2SO4酸性条件下,用Na2SO3还原NaClO3可制得ClO2,反应为:2NaClO3+Na2SO3 +H2SO4====2ClO2↑+2Na2SO4+H2O
这种方法的优点是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三1月月考化学试卷(解析版) 题型:填空题
(15分)能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g) △H=akJ·mol-1
CO(g)+1/2O2(g)= CO2(g) △H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=ckJ·mol-1
则反应:4Fe(s)+3O2(g)= 2Fe2O3(s)的焓变△H= kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)= 2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极: ,
正极: 。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:
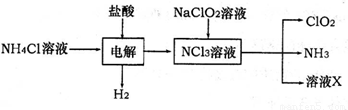
已知:电解过程中发生的反应为:
NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式 。
②在阳极上放电的物质(或离子)是 。
③除去ClO2中的NH3可选用的试剂是 (填序号)
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗 mol NCl3。
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修6 4.2身边化学问题的探究练习卷(解析版) 题型:选择题
世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用,由此可判断二氧化氯( )
A.是强氧化剂
B.是强还原剂
C.是离子化合物
D.分子中氯元素为-1价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com