
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
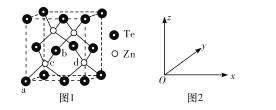
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
【答案】![]() 4 Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子 三角锥 sp3
4 Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子 三角锥 sp3 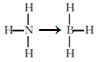 乙烷 ZnTe (
乙烷 ZnTe (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(l)铜是29号元素,基态Cu2+的外围电子排布式为3d9;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,据此分析解答;
(2)Mn2+的电子排布式为1s22s22p63s23p63d5,Fe2+的电子排布式为1s22s22p63s23p63d6,据此分析解答;
(3)氨气分子中的N原子有3个σ键和1个孤电子对;甲苯分子上甲基的碳原子形成4个σ键,没有孤电子对;氨硼烷中N原子提供孤电子对与B形成氢键,等电子体具有相同的原子数和价电子数,据此分析解答;
(4)①根据均摊法计算解答;②如图坐标中,过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,据此分析解答;③顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a结合晶胞质量计算晶体密度。
a结合晶胞质量计算晶体密度。
(l)铜是29号元素,基态Cu2+的外围电子排布式为3d9,外围电子排布图为![]() ;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,含有4个未成对电子,故答案为:
;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,含有4个未成对电子,故答案为:![]() ;4;
;4;
(2)Mn的电子排布式为1s22s22p63s23p63d54s2,失去2个电子后达到3d5稳定结构,再失去1个电子较难,而Fe2+的电子排布式为1s22s22p63s23p63d6,失去一个电子后3d变成半充满的稳定状态,所以Mn的第三电离能大于Fe的第三电离能,故答案为:Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子;
(3)氨气分子中的N原子有3个σ键和1个孤电子对,空间构型为三角锥形;甲苯分子上甲基的碳原子形成4个σ键,杂化方式为sp3;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷中N原子提供孤电子对与B形成氢键,结构式为 ;等电子体具有相同的原子数和价电子数,与氨硼烷互为CH3CH3,名称为乙烷,故答案为:三角锥;sp3;
;等电子体具有相同的原子数和价电子数,与氨硼烷互为CH3CH3,名称为乙烷,故答案为:三角锥;sp3; ;乙烷;
;乙烷;
(4)①顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a pm=
a pm=![]() a×10-10 cm,Te处于晶胞顶点与面心,晶胞中Te原子数目=8×
a×10-10 cm,Te处于晶胞顶点与面心,晶胞中Te原子数目=8×![]() +6×
+6×![]() =4,Zn原子处于晶胞内部,Zn原子数目=4,化学式为ZnTe,故答案为:ZnTe;
=4,Zn原子处于晶胞内部,Zn原子数目=4,化学式为ZnTe,故答案为:ZnTe;
②如图坐标中,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,针对坐标系的其它面也相同。c、d到xOy面的距离相等,即参数z关系,d到yOz面的距离是c的3倍,即参数x关系,b的参数y=0,c的参数y=
),过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,针对坐标系的其它面也相同。c、d到xOy面的距离相等,即参数z关系,d到yOz面的距离是c的3倍,即参数x关系,b的参数y=0,c的参数y=![]() ,则d到xOz面距离是c的3倍,即y参数关系,故d的参数:x=
,则d到xOz面距离是c的3倍,即y参数关系,故d的参数:x=![]() ,y=
,y=![]() ,z=
,z=![]() ,即参数坐标为(
,即参数坐标为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );
);
③顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a pm=
a pm=![]() a×10-10 cm,晶胞质量=4×
a×10-10 cm,晶胞质量=4×![]() g=
g=![]() g,晶体密度=
g,晶体密度=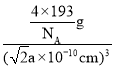 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如图:
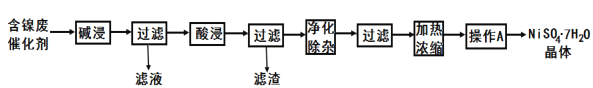
回答下列问题:
(1)滤液中的阴离子为_____。
(2)“酸浸”所使用的酸为_____。
(3)“净化除杂”是为了除铁,需加入H2O2溶液,溶液变成棕黄色,发生反应的离子方程式为__;一段时间后。溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是__;然后调节pH就可使溶液中铁元素完全沉淀,若使其刚好沉淀完全(离子浓度为1.0×10-5mol/L),此时的pH=__(保留一位小数)
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)关于铁铝化合物的下列说法正确的是__(填序号)。
①配制FeCl3、AlCl3溶液时,均是先将固体FeCl3、AlCl3溶于较浓的盐酸,再用蒸馏水稀释到所需浓度
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成
③利用氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+
④加热蒸干Al2(SO4)3溶液残留固体的成分为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下物质的转化关系图,回答有关问题:
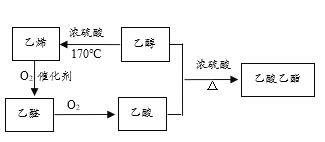
(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙醇中![]() 官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
(3)生成乙酸乙酯的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠是一种多用途的新型漂白剂,化学式可表示为aNa2CO3·bH2O2,过碳酸钠溶于水分解成Na2CO3和H2O2。
(1)FeOCl常用作过碳酸钠使用时的催化剂。FeCl3·6H2O在250℃时分解可得到FeOCl,该反应的化学方程式为______________________________________。
(2)测定某样品中过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
步骤Ⅰ:称取样品0.800 0 g于锥形瓶中,加水溶解,滴加甲基橙作指示剂,用0.200 0 mol·L-1H2SO4溶液滴定至终点,消耗硫酸25.00 mL。
步骤Ⅱ:另称取样品0.800 0 g于锥形瓶中,加水溶解,加稀硫酸酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点(滴定过程中MnO被还原为Mn2+),消耗KMnO4溶液30.00 mL。
①步骤Ⅰ中,滴定终点的现象是____________________。
②步骤Ⅱ中,若样品溶于水酸化后放置一段时间,然后再进行滴定,则过碳酸钠化学式中a∶b的测定结果将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该过碳酸钠化学式(写出计算过程)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究证明:核外电子的能量不仅与电子所处的电子层、能级有关,还与核外电子的数目及核电荷数有关。氩原子与硫离子的核外电子排布相同,都是![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子最外层都达8电子稳定结构,化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(![]() ,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩尔质量)
(忽略端基的摩尔质量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C.![]() 的稳定性很强,是因为其分子间能形成氢键
的稳定性很强,是因为其分子间能形成氢键
D.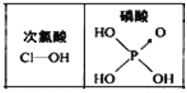 由图可知酸性:
由图可知酸性:![]() ,是因为
,是因为![]() 分子中有1个非羟基氧原子
分子中有1个非羟基氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.用K3[Fe(CN)6]检验Fe2+的离子反应方程式:2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ↓
B.含氟牙膏防治龋齿的原理是氟离子会跟羟基磷灰石发生沉淀转化生成氟磷灰石的离子反应方程式:Ca5(PO4)3(OH) +F- ![]() Ca5(PO4)3F +OH -
Ca5(PO4)3F +OH -
C.用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
D.已知在重铬酸钾溶液中存在着如下平衡:Cr2O72-+ H2O![]() H++ 2CrO42-
H++ 2CrO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入5 mol CO和4 mol NO,发生反应: 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,图1为平衡时NO的体积分数与温度、压强的关系。同时为探究催化剂对CO、NO转化率的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。下列说法中正确的是
N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,图1为平衡时NO的体积分数与温度、压强的关系。同时为探究催化剂对CO、NO转化率的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。下列说法中正确的是
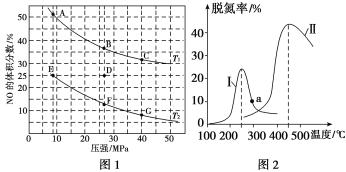
A.温度:T1<T2
B.若在D点对反应容器降温的同时缩小体积使体系压强增大,重新达到的平衡状态可能是图中G点
C.E点时NO的平衡转化率为50%
D.a点是对应温度下的平衡脱氮率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com