
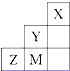
| A、电负性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
D、Z元素基态原子最外层电子排布图为  |


科目:高中化学 来源: 题型:
A、Na2SO4电离:Na2SO4=Na2++SO
| ||
B、Cl-的结构示意图: | ||
C、质子数为6,中子数为8的微粒:
| ||
| D、医用“钡餐”的化学式:BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、OH-、NO3-、Cl- |
| B、H+、Na+、CO32-、Cl- |
| C、H+、K+、NO3-、Cl- |
| D、Cu2+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| B、SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| C、用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 |
| D、用AgNO3溶液可以鉴别KCl和KI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、504mL |
| B、336mL |
| C、224mL |
| D、168mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol?L-1 |
| B、若V1=V2,反应后溶液的pH一定等于7 |
| C、若反应后溶液呈酸性,则V1一定大于V2 |
| D、若反应后溶液呈碱性,则V1一定小于V2. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①② | C、③④ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com