氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料.为探究氨气的性质,某研究性学习小组做了以下实验:
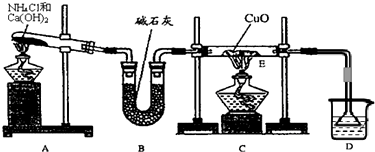
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气.
①实验室制取氨气的化学方程式为
.
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
.
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有
性.
(3)某同学查阅资料发现Cu
2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu
2O.已知:①Cu
2O是碱性氧化物,在酸性溶液中Cu
+不稳定,易转化为Cu和Cu
2+.
②在空气中高温灼烧时:Cu
2O稳定、不分解,而CuO将分解生成Cu
2O和O
2.
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu
2O.(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu
2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu
2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体.下列有关说法正确的是【已知:3Cu
2O+14HNO
3(稀)═6Cu(NO
3)
2+2NO↑+7H
2O】
:
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu
2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H
+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H
21.12L.




 阅读快车系列答案
阅读快车系列答案 2NH3△H<0
2NH3△H<0