
【题目】常温下,等体积的氨水和KOH两种溶液,其![]() ,下列说法正确的是
,下列说法正确的是![]()
A.![]() 的浓度小于KOH
的浓度小于KOH
B.分别向两溶液中加入盐酸完全中和后,溶液中水的电离程度前者大于后者
C.两溶液加水稀释过程中 、
、 均增大
均增大
D.分别加水稀释相同倍数后,溶液中![]()
【答案】B
【解析】
A、![]() 是弱碱部分电离,而KOH为强碱完全电离;
是弱碱部分电离,而KOH为强碱完全电离;
B、分别向两溶液中加入盐酸完全中和后,前者生成氯化铵和后者生成氯化钾;
C、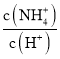 的分子和分母都乘氢氧根离子的浓度,得到
的分子和分母都乘氢氧根离子的浓度,得到![]() ,由此分析解答;
,由此分析解答;
D、加水稀释钾离子和铵根离子的浓度都减小,但加水稀释加水稀释促进一水合氨的电离,所以铵根离子浓度变大。
![]() 是弱碱部分电离,而KOH为强碱完全电离,而等体积的氨水和KOH两种溶液,其
是弱碱部分电离,而KOH为强碱完全电离,而等体积的氨水和KOH两种溶液,其![]() ,所以
,所以![]() 的浓度大于KOH,故A错误;
的浓度大于KOH,故A错误;
B、分别向两溶液中加入盐酸完全中和后,前者生成氯化铵和后者生成氯化钾,氯化铵溶液水解呈酸性,对水的电离起促进作用,所以溶液中水的电离程度前者大于后者,故B正确;
C、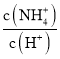 的分子和分母都乘氢氧根离子的浓度,得到
的分子和分母都乘氢氧根离子的浓度,得到![]() ,加水稀释过程一水合氨的浓度减小,比值减小,故C错误;
,加水稀释过程一水合氨的浓度减小,比值减小,故C错误;
D、加水稀释钾离子和铵根离子的浓度都减小,但加水稀释促进一水合氨的电离,所以铵根离子浓度变大,即溶液中![]() ,故D错误;
,故D错误;
故选:B。


科目:高中化学 来源: 题型:
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A.pH均为4的H2SO4、NH4Cl溶液中,水的电离程度相同
B.等pH的NaOH溶液与NH3H2O 稀释后pH的变化如右图所示,则曲线I表示的是NaOH溶液的稀释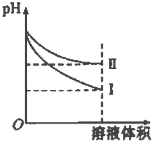
C.1mol/LNa2CO3溶液中存在:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
D.向某温度的氨水中通入盐酸,则氨水的电离常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z的离子具有相同的核外电子排布,离子半径Y大于Z,Y与Z可形成常见的离子化合物,原子半径X大于Z,则下列说法中不正确的是![]()
A.原子序数一定是![]()
B.X、Z两种元素的单质的沸点一定是![]()
C.Z的最高价氧化物一定能溶于X、Y的最高价氧化物的水化物
D.工业上获得X、Z单质的方法主要是电解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F代表周期表中五种短周期元素,已知:
![]() 、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
![]() 与C处于周期表中同一周期,
与C处于周期表中同一周期,![]() 中各层电子数都是
中各层电子数都是![]() 个。
个。
![]() 、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
![]() 是半径最小的原子。据此填空下列空白:
是半径最小的原子。据此填空下列空白:
![]() 写出各元素的名称A ______ C ______ E ______
写出各元素的名称A ______ C ______ E ______
![]() 写出A和D形成化合物的电子式 ______
写出A和D形成化合物的电子式 ______
![]() 、C、D三种元素单原子离子的半径由大到小的顺序: ______
、C、D三种元素单原子离子的半径由大到小的顺序: ______
![]() 、B的氢化物的熔沸点大小并写出原因: ______
、B的氢化物的熔沸点大小并写出原因: ______
![]() 写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某密闭容器中存在如下反应A(g)+xB(g) ![]() 2C(g),反应过程中有关量值变化如下图所示,下列说法中错误的是( )
2C(g),反应过程中有关量值变化如下图所示,下列说法中错误的是( )
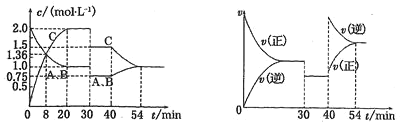
A.30 min时扩大了容器的容积
B.首次平衡时的K=4
C.40 min时增大了压强
D.8 min前A的平均反应速率为0.8 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl –
B.![]() =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.![]() 的溶液中: K+、NH
的溶液中: K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中: Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在氧化铜作催化剂的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点(℃) | 20.8 | 117.9 | 290 | 197.2 | 100 |
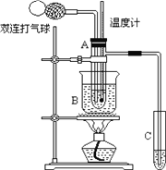
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为_______________。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是___________;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处;目的是_________。
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是____。(写出一种即可,在题给物质中找);某同学认为试管C最好置于冰水浴中,其目的是________。
(4)对C中产品进行蒸馏时,蒸馏烧瓶中加入少量___,以除去其中含有的少量水。
A.浓硫酸 B.CaO C.CuSO4溶液 D.无水CaCl2
(5)以下区分乙酸精品和粗品的方法,合理的是_____。
A.加入水观察实验现象
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象
C.加入碳酸氢钠溶液,振荡后观察实验现象
D.加入少量Na单质,振荡后观察实验现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com