
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是
操作 | 现象 | |
A | 加入NaOH溶液 | 有红褐色沉淀 |
B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
C | 加入酸性KMnO4溶液 | 紫色褪去 |
D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
A. A B. B C. C D. D
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
下列反应中,氧元素被还原的是
A. 2Na+O2 Na2O2 B. Na2O+H2O=2NaOH
Na2O2 B. Na2O+H2O=2NaOH
C. 2F2+ 2H2O=4HF+ O2 D. 2C+SiO2 2CO↑+Si
2CO↑+Si
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:选择题
下列除去杂质中,所有的除杂试剂不正确的是( )
序号 | 主要成分 | 杂质 | 所用除杂试剂 |
A |
|
|
|
B |
|
| 盐酸 |
C |
|
|
|
D | 工业用水 |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2017届高三3月双基测试化学试卷 题型:简答题
CO和H2均是重要的化工原料,CO2的固定和利用对环境保护及能源开发具有重要的意义。
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.8kJ·mol-1
CH3OH(g) △H1=-90.8kJ·mol-1
水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.3kJ·mol-1
CO2(g)+H2(g) △H2=-41.3kJ·mol-1
甲醇脱水反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式____________。
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:

①p1、p2、p3中最大的是________。
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为____mol·L-1·min-1。
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性______(填“减弱”、“增强”或“不变”),Y电极是_____极,写出X电极上发生的电极反应式__________。若用该二甲醚燃料电池电解饱和食盐水(阳极为石墨电极),当有2.3g燃料被消耗时,阴极产生气体的体积为_____L(标准状况下)

查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2017届高三3月双基测试化学试卷 题型:选择题
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
A. H2(g)的燃烧热为571.6kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)ΔH=-57.3kJ·mol-1
D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2017届高三3月双基测试化学试卷 题型:选择题
能正确表示下列反应的离子方程式是
A. 用石墨作电极电解CuCl2溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C. 将少量二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O
D. Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3+H2O
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三下学期第一次月考理科综合化学试卷(解析版) 题型:简答题
工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下:
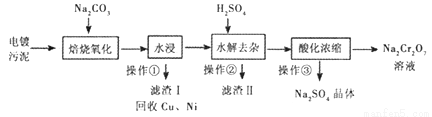
【查阅资料】
①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质;
②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表:

请回答:
(1)操作①的名称是_______,“水浸”后的溶液呈_______性;
(2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________;
(3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________;
(4)“酸化浓缩”时,需继续加入H2SO4,然后_______、结晶、过滤。继续加入H2SO4目的是__________;
(5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如图所示。

①阴极发生的电极反应式为:_____________;
②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三2月适应性考试(一)理综化学试卷(解析版) 题型:选择题
锂一二硫化亚铁电池是一种高容量电池,用途广泛,该电池放电时的总反应为:4Li+FeS2=Fe+2Li2S。下列说法正确的是
A. 放电时,负极反应为:Li-e-=Li+
B. 放电时,正极发生氧化反应
C. 硫酸、羧酸及醇类物质都可以用作该锂电池的电解质
D. 充电时,阳极只有Fe参与放电
查看答案和解析>>
科目:高中化学 来源:广东省2016-2017学年高一上学期期末考试化学试卷 题型:填空题
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) 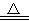 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com