
| A、加成反应 | B、分解反应 |
| C、酯化反应 | D、取代反应 |


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
 砷化镓为第三代半导体材料,晶胞结构如图所示,
砷化镓为第三代半导体材料,晶胞结构如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:
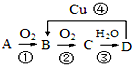 已知A、B、C、D之间存在如图转化关系,试回答下列问题:
已知A、B、C、D之间存在如图转化关系,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应①的氧化剂是Sb2S3,反应②的氧化剂是Sb4O6 |
| B、反应①中每生成3 mol FeS时,共转移6 mol电子 |
| C、反应②说明高温下Sb的还原性比C强 |
| D、反应①的氧化产物是Sb4O6和FeS,反应②的氧化产物是CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y被还原,X2+是氧化产物 |
| B、Y被还原,X发生还原反应 |
| C、X是还原剂,Y被氧化 |
| D、X被氧化,X显氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | c(HA)/mol?L-1 | c(NaOH)/mol?L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH=9 |
| 乙 | c1 | 0.2 | pH=7 |
| A、0.1mol?L-1的HA溶液中由水电离出的c(H+)>1×10-13mol/L |
| B、c1一定大于0.2mol?L-1 |
| C、甲反应后的溶液中:HA占含A微粒总数的0.01% |
| D、乙反应后的溶液中:c(Na+)<c(HA)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应中镁发生了氧化反应 |
| B、该反应中二氧化碳是还原剂 |
| C、该反应属于置换反应 |
| D、镁着火时不能用二氧化碳灭火剂扑灭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com