
【题目】电镀工业上,为了提高镀锌的效果,通常采用Zn(CN)42-溶液代替Zn2+溶液进行电解。请回答下列问题:
(1)元素锌在周期表中的位置为_____________,基态Zn的价电子排布式为_____________。
(2)Zn(CN) 42-所含元素中,电负性最大的元素是_____________,Zn(CN) 42-中含有的化学键类型有σ键和_____________。
(3)CN-中C的杂化类型为_____________,与CN-互为等电子体的单质为_____________。
(4)H2CO3与HNO3的酸性相差较大,请解释其原因_____________。
(5)N和Al可组成一种新型半导体材料AlN;AlN具有耐高温,耐磨性能。其晶体类型为_____________,其晶体结构如图,已知晶胞边长为apm,则AlN的密度为_____________(用含a、NA的代数式表示)g/cm3。
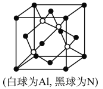
【答案】第四周期ⅡB族 3d104s2 N π键 sp N2 HNO3非羟基氧多于H2CO3,非羟基氧吸电子导致—OH中H易电离 原子晶体 ![]()
【解析】
(1)根据元素对应的原子结构判断元素在周期表中的位置;根据构造原理书写其核外电子排布式;
(2)元素的非金属性越强,元素的电负性就越大;单键为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键;
(3)依据价层电子对数判断杂化类型;价电子和原子数分别都相同的分子是等电子体;
(4)含氧酸的酸性强弱与非羟基氧数目有关,非羟基氧数目越多,酸性越强;
(5)原子晶体熔、沸点高、硬度大;运用均摊法计算晶胞中AlN的个数,依据![]() 计算AlN的密度。
计算AlN的密度。
(1)Zn是30号元素,位于周期表第四周期ⅡB族,根据核外电子排布规律可知,Zn的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,价电子排布式为3d104s2,故答案为:第四周期ⅡB族;3d104s2;
(2)元素的非金属性越强,元素的电负性就越大,Zn(CN) 42-所含元素中N元素非金属性最强,电负性最大;[Zn(CN)4]2-中CN-离子中含有C、N叁键,化学键类型有σ键和π键,故答案为:N;π键;
(3)CN-中C原子与N原子之间形成叁键,则C的杂化类型为sp杂化;价电子和原子数分别都相同的分子是等电子体,所以和CN-互为等电子体的单质分子是氮气,故答案为:sp杂化;N2;
(4)H2CO3与HNO3都为含氧酸,硝酸中含有2个非羟基氧,碳酸中含有1个非羟基氧,非羟基氧越多,吸电子能力更强,导致—OH中H更易电离,故答案为:HNO3非羟基氧多于H2CO3,非羟基氧吸电子导致—OH中H易电离;
(5)原子晶体熔、沸点高、硬度大,根据AlN具有有耐高温、,耐磨性能的性质可知,AlN为原子晶体;由晶胞结构示意图可知,晶胞中含有4个AlN,则晶胞的质量为![]() g,晶胞的体积为(a×10—10m)3,则有d(a×10—10m)3=
g,晶胞的体积为(a×10—10m)3,则有d(a×10—10m)3=![]() ,d=
,d=![]() ,故答案为:原子晶体;
,故答案为:原子晶体;![]() 。
。


科目:高中化学 来源: 题型:
【题目】A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )

A. A、B、C中一定有一种是氧元素的单质
B. 单质B肯定是氧化剂
C. D、E中一定都含有A的元素
D. 若A是非金属,则B一定为金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 溴水中有如下平衡:Br2+H2OHBr+HBrO,加入AgNO3溶液后,溶液颜色变浅
B. 合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C. 氯气在水中的溶解度大于在饱和食盐水中的溶解度
D. 对CO(g)+NO2(g)CO2(g)+NO(g)平衡体系增大压强可使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体和溶液的特征区别是( )
A. 胶体属于介稳体系 B. 胶体粒子的大小在1nm~100nm之间
C. 胶体具有丁达尔效应 D. 胶体粒子不能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电镀车间的含铬酸性废水中,铬的存在形式有Cr(Ⅵ)和Cr(Ⅲ)两种,其中以Cr(Ⅵ)的毒性最大。电解法处理含铬废水如图,铬最终以Cr(OH)3沉淀除去。下列说法正确的是
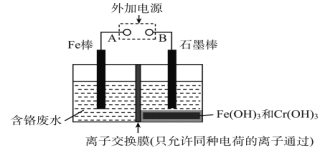
A. Fe为阳极,反应为Fe-2e-=Fe2+
B. 阴极反应为Cr2O72-+7H2O+6e-=2Cr(OH)3↓+8OH-
C. 阳极每转移3mol电子,可处理Cr(Ⅵ)物质的量为1mol
D. 离子交换膜为质子交换膜,只允许H+穿过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
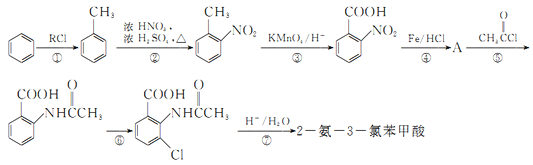
已知:
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
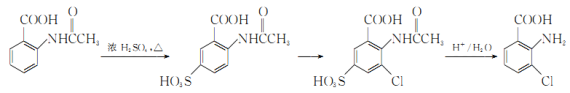
分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质转化的框图答题:

(1)按官能团分类,X所属类别是_________________________。
(2)反应①所属反应类型为___________________________。
(3)写出反应①、②的化学反应方程式:①______________________;②_____________。
(4)有机物Y核磁共振氢谱显示有两组峰,其结构简式为_______________。
(5)已知:乙烯和1,3—丁二烯在催化剂作用下可发生反应:![]() 。现以X和1,3-丁二烯为原料在催化剂作用下反应,生成的有机物的结构简式为(用键线式表示)_______________。
。现以X和1,3-丁二烯为原料在催化剂作用下反应,生成的有机物的结构简式为(用键线式表示)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是
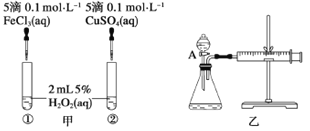
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞。将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是某种药物的主要成分,工业上合成该化合物的一种路线如下(部分反应物、反应条件略去):

已知:酯与含羟基的化合物可发生如下酯交换反应:RCOO R′+R″OH![]() RCOOR″+R′OH(R、R′、R″均代表烃基)。
RCOOR″+R′OH(R、R′、R″均代表烃基)。
(1)反应①所需的试剂是_______,反应②的反应类型是_________。
(2)B中含氧官能团的名称是________;反应④的产物除了X以外,另一种产物的名称是________。
(3)D在一定条件下能发生缩聚反应生成高分子化合物,该高分子化合物的结构简式为____________。
(4)反应③的化学方程式为_______________________。
(5)E的同分异构体有多种,写出符合下列条件的有机物结构简式________。
Ⅰ.苯环上一氯代物只有一种
Ⅱ.与氯化铁溶液发生显色反应
Ⅲ.能与碳酸氢钠溶液反应放出CO2
(6)已知:①![]()
![]()
![]() ;②当苯环上已有一个“—CH3”或“—Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“—NO2”或“—COOH”时,新引入的取代基一般在它的间位。请写出以甲苯、乙醇为原料制备
;②当苯环上已有一个“—CH3”或“—Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“—NO2”或“—COOH”时,新引入的取代基一般在它的间位。请写出以甲苯、乙醇为原料制备 的合成路线图(无机试剂任用)____________。
的合成路线图(无机试剂任用)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com