
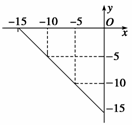
 I.(4��)ij�¶��µ���Һ�У�c(H��)=10x mol/L,c(OH��)=10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ��
I.(4��)ij�¶��µ���Һ�У�c(H��)=10x mol/L,c(OH��)=10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ��
��1�����¶���,������Һ��pH= ��
��2�����¶���0.01 mol/L NaOH��Һ��pH= ��
II. (6��)ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
��1����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹǿ(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ�� (��10��3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ����� ������ĸ����
A��2v(NH3)=v(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�ڸ��ݱ������ݣ�����25.0��ʱ�ķֽ�ƽ�ⳣ��Ϊ ��
��2����֪��NH2COONH4��2H2O![]() NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
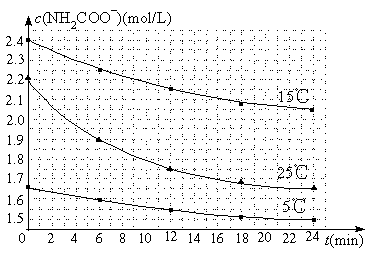
�ۼ���25��ʱ��0��6min���������ˮ�ⷴӦ��ƽ������Ϊ ��
�ܸ���ͼ����Ϣ�����˵��ˮ�ⷴӦ��ƽ���������¶����߶�����
��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��15�֣���Դ��ȱ���������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϡ�
��1����֪�ڳ��³�ѹ�£�
��2CH3OH(I)ʮ3O2(g) 2CO2(g)+4H2O(g) ��H= _1275.6 kJ��mol��1
��H2O(I) === H2O(g) ��H=+ 44.0 kJ.mol-1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ (2��).
��2����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦA��CO2��g��+3H2��g��CH3OH��g��+H2O��g�� ��H1
��ӦB��CO��g��+2H2��g��CH3OH��g�� ��H2
ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ��������ͼ��ʾ��������CO2ת��Ϊ�״��ķ�Ӧ�ġ�H1________0�������������������������2�֣�
�ڶ��ڷ�ӦA���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��2�֣���
A�������¶� B������CO2����
C������He��ʹ��ϵ��ѹǿ���� D����ԭ�����ٳ���CO2��H2
��ij�¶��£���4mol CO��12mol H2,����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO) =0.5 mol��L��1��������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ ��2�֣���
��.ij�ּ״�������ȼ�ϵ���Dz��ò���Ϊ�缫��ϡ�������������Һ���乤��ʱ�����ĵ缫��Ӧʽ�ɱ�ʾΪ______________________ ��2�֣�
��3����ȼú�����е�SO2��NO2�����ʵ���֮��Ϊ1��1,��һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʡ�����÷�Ӧ�Ļ�ѧ����ʽΪ________ ����3�֣���4����һ�����ʵ���Ũ�ȵ��������Һ�еμ�������NaOH��Һ��ʹ��Һ��pH=7����
��Һ��c��Na+��+c��H+��_____ c��NO3-��+c��OH-������д��������������������2�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���㽭ʡ�ص���ѧЭ�������3�µ������۲��֣��������� ���ͣ������
��15�֣���Դ��ȱ���������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϡ�
��1����֪�ڳ��³�ѹ�£�
��2CH3OH(I)ʮ3O2(g) 2CO2(g)+4H2O(g) ��H= _1275.6 kJ��mol��1
��H2O(I) ="==" H2O(g) ��H="+" 44.0 kJ.mol-1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ (2��).
��2����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦA��CO2��g��+3H2��g�� CH3OH��g��+H2O��g����H1
CH3OH��g��+H2O��g����H1
��ӦB��CO��g��+2H2��g�� CH3OH��g�� ��H2
CH3OH��g�� ��H2
ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ��������ͼ��ʾ��������CO2ת��Ϊ�״��ķ�Ӧ�ġ�H1________0�������������������������2�֣�
�ڶ��ڷ�ӦA���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��2�֣���
| A�������¶� | B������CO2���� |
| C������He��ʹ��ϵ��ѹǿ���� | D����ԭ�����ٳ���CO2��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���Ĵ�ʡ�����ڶ����¿������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
��15�֣���Դ��ȱ���������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϡ�
��1����֪�ڳ��³�ѹ�£�
��2CH3OH(I)ʮ3O2(g)
2CO2(g)+4H2O(g) ��H= _1275.6 kJ��mol��1
��H2O(I) === H2O(g) ��H=+ 44.0 kJ.mol-1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ (2��).
��2����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦA��CO2��g��+3H2��g�� CH3OH��g��+H2O��g�� ��H1
CH3OH��g��+H2O��g�� ��H1
��ӦB��CO��g��+2H2��g�� CH3OH��g�� ��H2
CH3OH��g�� ��H2
ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH�� �뷴Ӧ�¶�T�Ĺ�ϵ��������ͼ��ʾ��������CO2ת��Ϊ�״��ķ�Ӧ�ġ�H1________0�������������������������2�֣�

�ڶ��ڷ�ӦA���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��2�֣���
A�������¶� B������CO2����
C������He��ʹ��ϵ��ѹǿ���� D����ԭ�����ٳ���CO2��H2
��ij�¶��£���4mol CO��12mol H2,����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO) =0.5 mol��L��1��������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ ��2�֣���
��.ij�ּ״�������ȼ�ϵ���Dz��ò���Ϊ�缫��ϡ�������������Һ���乤��ʱ�����ĵ缫��Ӧʽ�ɱ�ʾΪ______________________ ��2�֣�
��3����ȼú�����е�SO2��NO2�����ʵ���֮��Ϊ1��1,��һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʡ�����÷�Ӧ�Ļ�ѧ����ʽΪ________ ����3�֣���4����һ�����ʵ���Ũ�ȵ��������Һ�еμ�������NaOH��Һ��ʹ��Һ��pH=7����
��Һ��c��Na+��+c��H+��_____ c��NO3-��+c��OH-������д��������������������2�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
(12��)������ʵĵ���ƽ�⡢�����ˮ��ƽ������������Һƽ������ڻ�ѧƽ�⡣
I����֪H2A��ˮ�д�������ƽ�⣺H2A H��+HA����HA��
H��+HA����HA�� H��+A2����
H��+A2����
��NaHA��Һ (ѡ������ԡ��� ���Լ��ԡ��� �������ԡ�����ȷ����)��
��ij�¶��£�����0.1 mol/L��NaHA��Һ����εμ�0.1 mol/L KOH��Һ����Һ�����ԡ���ʱ�û����Һ�����й�ϵ�У�һ����ȷ���� ��
a��c(H��)��c(OH��)��1��10�D14 b��c(Na��)+c(K��)��c(HA��)+2c(A2��)
c��c(Na��)��c(K��) d��c(Na��)+c(K��)��0.05 mol/L
����֪������H2A�ĸ���(CaA)������Һ�д�������ƽ�⣺
CaA(s) Ca2��(aq)+A2��(aq) ��H��0��
Ca2��(aq)+A2��(aq) ��H��0��
���¶Ƚ���ʱ��Ksp (���������С�����䡱����ͬ)��
�ڵμ�����Ũ���ᣬc(Ca2��) ��
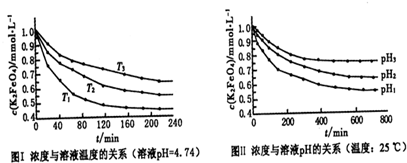
II������Cr2O72���ķ�ˮ���Խϴ�ij������ˮ�к�5.00��10��3 mol��L��1��Cr2O72����Ϊʹ��ˮ�ܴ���ŷţ������´�����
Cr2O72�� Cr3����Fe3+
Cr3����Fe3+ Cr(OH)3��Fe(OH)3
Cr(OH)3��Fe(OH)3
����ʹ10L�÷�ˮ�е�Cr2O72����ȫת��ΪCr3+����������Ҫ���� g FeSO4��7H2O��
����������ķ�ˮ�в�����c(Fe3+)��2��10��13mol��L��1���������Cr3+��Ũ��Ϊ ��(��֪��Ksp[Fe(OH)3]��4.0��10��38 Ksp[Cr(OH)3]��6.0��10��31)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com