
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(g) +B(s)![]() 3C(?),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
3C(?),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
A. 改变压强对该平衡的移动一定无影响
B. 平衡体系中加入少量B,平衡向逆反应方向移动
C. 若正反应是吸热反应,则C为非气态
D. 若正反应是放热反应,则C为非气态
科目:高中化学 来源: 题型:
【题目】从海水中可以提取溴,主要反应为: 2Br Cl2 Br2 2Cl,下列说法正确的是( )
A. 溴离子具有氧化性 B. 氯气是还原剂
C. 该反应属于复分解反应 D. 氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确的是
①C(s) + H2O(g)=CO(g) + H2 (g) ΔH1 = a kJ·mol-1
②CO(g) + H2O(g)=CO2 (g) + H2 (g) ΔH 2 = b kJ·mol-1
③CO2 (g) + 3H2 (g)=CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol-1
④2CH3OH(g)=CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol-1
A. 反应③的原料是由反应①、②提供的
B. 反应③可以作为解决温室效应方案之一
C. 反应CH3OH(g)=CO (g) +2H2(g)的ΔH =(-b-c)kJ·mol-1
D. 反应 2CO(g) + 4H2 (g)=CH3OCH3 (g) + H2O(l)的ΔH = ( 2b + 2c + d ) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列保存物质的方法正确的是( )
A. 液溴易挥发,存放在带橡胶塞的试剂瓶中,并加水封
B. 波尔多液盛放在铁制容器中
C. 氨水易挥发,应密封且在低温处保存
D. 金属锂应保存在煤油中,防止被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是
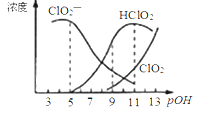
A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钡是白色的晶体,易溶于水,微溶于盐酸和硝酸,难溶于乙醇和乙醚,易吸湿,需密封保存。工业上制备BaCl2·2H2O有如下两种途径:
途径1:以重晶石(主要成分BaSO4)为原料,流程如下:
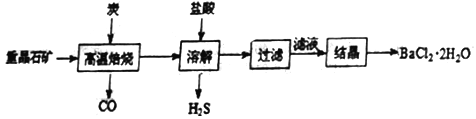
(1)写出“溶解”时反应的化学方程式方程式:________________________。
(2)“高温焙烧”时必须加入过量的炭,同时还要通入空气,其目的是_____________。
(3)结晶得到的晶体,需用乙醇洗涤的理由是_______________________。
途径2:以毒重石(主要成分BaCO3,含CaCO3、MgCO3、Fe2O3、SiO2等杂质)为原料,流程如下:
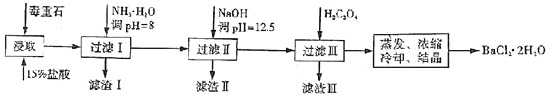
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,Ksp[Mg(OH)2]=1.8×10-11。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(4)滤渣I的成分为________(填化学式)。
(5)滤渣II中含_________(填化学式)。过滤析出后,滤液中含有的Mg2+浓度为_______。
(6)加入H2C2O4时应避免过量,其原因是为了防止生成______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一块非常独特的手表,用H~Mg 12种元素分别表示1:00~12:00,关于此表的下列说法中不正确的是

A.2:00时的时针和12:00时的分针所指元素极难形成化合物
B.7:00时,时针和分针所指元素可能形成相对分子质量为100的化合物
C.8:00时,时针和分针所指元素形成的氧化物属于碱性氧化物
D.3:00时,时针所指元素的金属性比11:00时时针所指元素的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
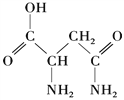
(1)硒、铬、锰元素中,________(填元素符号)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有________种。
(3)已知NN的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,则N2中的________
键稳定(填“σ”或“π”)。
Ⅱ.胆矾CuSO45H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:
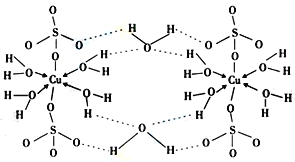
(4)下列说法正确的是_______(填字母)。
A.胆矾所含元素中,H、O、S的半径及电负性依次增大
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.加热条件下胆矾中的水会在相同温度下一同失去
(5)往硫酸铜溶液中加入过量氨水,溶液变为深蓝色,写出所发生反应的离子方程式__________________________;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】b g某金属与足量的稀硫酸反应,生成该金属的三价正盐和a g氢气.则该金属的相对原子质量为( )
A. 2b/a B. 3b/2a C. 3b/a D. a/3b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com