氮化硅(Si
3N
4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:
3SiO
2(s)+6C(s)+2N
2(g)?Si
3N
4(s)+6CO(g)+Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO)=
0.25mol/L?min
0.25mol/L?min
;该反应的平衡常数表达式为
.
(2)其它条件不变时仅增大压强,则
c
c
.
a.K值减小,平衡向逆反应方向移动
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是
cd
cd
.
a.c(N
2 ):c(CO)=1:3 b.3v(N
2 )=v(CO) c.固体质量不再改变 d.气体密度不再改变
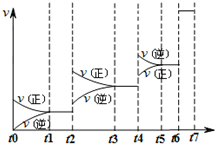
(4)达到平衡后改变某一条件,反应速率v与时间t的关系如图所示.
若不改变N
2与CO的量,则图中t
4时引起变化的原因可能是
升高温度后压缩体积增大压强
升高温度后压缩体积增大压强
;图中t
6时引起变化的原因可能是
加入催化剂
加入催化剂
.由图可知,平衡混合物中CO含量最高的时间段是
t3~t4
t3~t4
.

 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案