
| A. | 漂白粉 | B. | 液氯 | C. | 明矾 | D. | 胆矾 |
分析 A、漂白粉的成分为氯化钙、次氯酸钙的混合物,溶于水会水解生成次氯酸具有氧化性,起到杀菌消毒作用;
B、液氯溶于水生成次氯酸具有强氧化性,能杀菌消毒;
C、明矾溶于水溶液中铝离子水解生成氢氧化铝胶体,具有较大表面积,可以吸附悬浮杂质;
D、胆矾是硫酸铜晶体溶于水得到溶液不能除去悬浮杂质;
解答 解:A、漂白粉溶于水会水解生成次氯酸具有氧化性,起到杀菌消毒作用,不能除去河水中的悬浮杂质使河水变澄清,故A错误;
B、液氯溶于水生成次氯酸具有强氧化性,能杀菌消毒,不能除去河水中的悬浮杂质,故B错误;
C、明矾溶于水溶液中铝离子水解生成氢氧化铝胶体,具有较大表面积,可以吸附悬浮杂质,除去河水中的悬浮杂质,使河水变澄清,故C正确;
D、胆矾是硫酸铜晶体溶于水得到硫酸铜溶液,不能除去悬浮杂质,故D错误;
故选C.
点评 本题考查了盐类水解的分析应用,主要是物质性质的理解应用,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓硫酸和乙醇制乙烯时,应把温度计的水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 用浓硫酸配置一定物质的量浓度的稀硫酸时,应在量取浓硫酸后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中 | |
| C. | 液态溴应贮存在磨口的细口瓶中,加水液封,加盖橡胶塞,并放置于阴凉处 | |
| D. | 应用渗析法提纯胶体时,要不断更换烧杯中的水(或用流动的水)以提高渗析效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (a+b+c)L | B. | 2(a+b+c)L | C. | (a+b+2c)L | D. | 3(a+b+c)L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
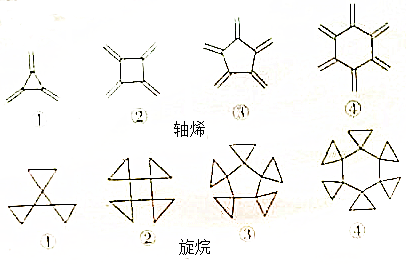
 ,Y
,Y .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 取含HCl和MgSO4的混合溶液1L,逐滴加入1mol•L-1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图:
取含HCl和MgSO4的混合溶液1L,逐滴加入1mol•L-1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com