
【题目】全球气候变暖已经成为全世界人类面临的重大问题,研究CO2的利用对促进低碳社会的构建具有重要意义。
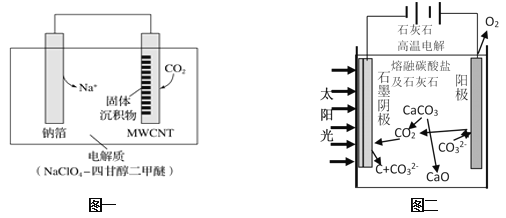
(1)利用“Na﹣CO 2”电池将CO 2变废为宝。我国科研人员研制出的可充电“Na﹣CO 2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO22Na2CO3+C.放电时该电池“吸入”CO 2,其工作原理如图一所示:
①放电时,正极产物全部以固体形式沉积在电极表面,正极的电极反应式为__________________。
②放电时,当转移0.1mol e-时,负极质量减少_____ g。
(2)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图二所示:
①上述生产过程的能量转化方式是____________________________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极放电的电极反应式为____________________________。
【答案】3CO2+4Na++4e-=2Na2CO3+C 2.3 太阳能和电能转化为化学能 2CO32--4e-=2CO2↑+ O2↑
【解析】
(1)①由示意图可知,正极上CO2得电子发生还原反应上生成C;
②负极上发生的电极反应4Na-4e-=4Na+;
(2)①据图示可知是太阳能和电能转化为化学能的变化过程;
②在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程。
(1)①由示意图可知,正极上CO2得电子发生还原反应上生成C,故电极方程式为3CO2+4Na++4e-=2Na2CO3+C,故答案为:3CO2+4Na++4e-=2Na2CO3+C;
②负极上发生的电极反应4Na-4e-=4Na+,则负极质量减少为0.1mol×23g/mol=2.3g,故答案为:2.3;
(2)①据图示可知是太阳能和电能转化为化学能的变化过程,故答案为:太阳能和电能转化为化学能;
②在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,电极反应式为:2CO32--4e-═2CO2↑+O2↑,故答案为:2CO32--4e-═2CO2↑+O2↑。


科目:高中化学 来源: 题型:
【题目】两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述正确的是

A. MOH是一种弱碱
B. 在x点,((M+)=c(R+)
C. 稀释前,c(MOH)=l0c(ROH)
D. 稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
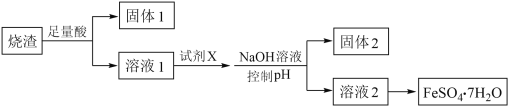
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,充入2mol气体A和1mol气体B发生反应:
3A(g)+2B(g)![]() 2C(?)+4D(?)。反应一段时间后达到平衡,测得生成1.6molD,反应前后体系压强之比为5:3。则下列说法正确的是 ( )
2C(?)+4D(?)。反应一段时间后达到平衡,测得生成1.6molD,反应前后体系压强之比为5:3。则下列说法正确的是 ( )
A. 物质D一定是气体
B. 气体A的平衡转化率大于气体B的平衡转化率
C. 平衡后若减小该体系的压强,平衡向左移动,化学平衡常数减小
D. 平衡后升高温度,若平衡向右进行,则正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应过程中体系的能量变化如图所示,下列说法错误的是
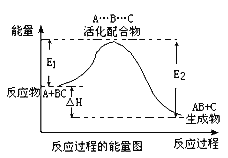
A. 该反应不一定能自发进行
B. E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C. 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D. 加入合适催化剂,△H不变,E1、E2也不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。该有机物的化学式是( )
A. C2H4 B. C2H6O2 C. C2H6O D. C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.氯化钠可用于生产金属钠和氯气
B.铁的冶炼和普通玻璃的生产都要用到石灰石
C.SO2和CO2都是“城市空气质量日报”的报道内容
D.石墨质软、能导电,常用作润滑剂和电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知2C(s)+2O2(g) == 2CO2(g) ΔH1, 2C(s)+O2(g)==2CO(g) ΔH2,则ΔH1<ΔH2
C. 已知H+(aq)+OH-(aq) == H2O(l) ΔH=-57.3kJ·mol-1,则任何酸碱中和反应的热效应数值均为57.3kJ
D. 已知C(石墨,s) == C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com