
(16分)化合物K2Fe(C2O4)y?3H2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
⑴结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是:__________________。
⑵操作Ⅲ的名称是____________________。
Ⅱ.组成测定:称取一定质量实验所得晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O42-完全转化为H2C2O4,用0.10mol?L-1KMnO4溶液进行滴定,消耗KMnO4溶液24.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应如下:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
![]() MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
![]() ⑶配制l00mL 0.10mol?L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 (写名称)。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
⑶配制l00mL 0.10mol?L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 (写名称)。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
![]() ⑷通过计算,该化合物KxFe(C2O4)y?3H2O中的x= 。
⑷通过计算,该化合物KxFe(C2O4)y?3H2O中的x= 。
科目:高中化学 来源:广东省2009届高三化学各地名校月考试题汇编-实验探究(1) 题型:058
化合物K2Fe(C2O4)y·3H2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成.
Ⅰ.制备:
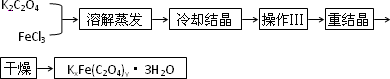
(1)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是:________.
(2)操作Ⅲ的名称是________.
Ⅱ.组成测定:
称取一定质量实验所得晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O42-完全转化为H2C2O4,用0.10 mol·L-1 KMnO4溶液进行滴定,消耗KMnO4溶液24.00 mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00 mL.相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(3)配制100 mL 0.10 mol·L-1 KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________和________名称).两个滴定中到达终点时溶液颜色为________色,且30秒内不变色.
(4)通过计算,该化合物KxFe(C2O4)y·3H2O中的x=________.
查看答案和解析>>
科目:高中化学 来源:广东省2009届高三化学各地名校月考试题汇编-铁铜及其化合物(1) 题型:058
化合物K2Fe(C2O4)y·3H2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成.
Ⅰ.制备:

(1)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是:________.
(2)操作Ⅲ的名称是________.
Ⅱ.组成测定:
称取一定质量实验所得晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O42-完全转化为H2C2O4,用0.10 mol·L-1 KMnO4溶液进行滴定,消耗KMnO4溶液24.00 mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00 mL.相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(3)配制100 mL 0.10 mol·L-1 KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________和________名称).两个滴定中到达终点时溶液颜色为________色,且30秒内不变色.
(4)通过计算,该化合物KxFe(C2O4)y·3H2O中的x=________.
查看答案和解析>>
科目:高中化学 来源:广东英德中学2010届第一次月考理科综合化学试题 题型:058
化合物K2Fe(C2O4)y·3H2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成.
Ⅰ.制备:
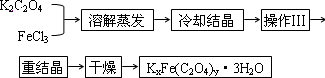
(1)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是:________________________.
(2)操作Ⅲ的名称是________.
Ⅱ.组成测定:称取一定质量实验所得晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O42-完全转化为H2C2O4,用0.10 mol·L-1 KMnO4溶液进行滴定,消耗KMnO4溶液24.00 mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00 mL.相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(3)配制100 mL 0.10 mol·L-1 KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________和________(写名称).两个滴定中到达终点时溶液颜色为________色,且30秒内不变色.
(4)通过计算,该化合物KxFe(C2O4)y·3H2O中的x=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)化合物KxFe(C2O4)y·zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3mol/LH2SO4和适量的蒸馏水,加热到75℃,趁热加入0.0500mol/L KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL 0.0500mol/L KMnO4溶液完全反应。通过计算,分别求:
(1)0.491g样品中结晶水的物质的量。
(2)化合物中草酸根的质量分数。
(3)化合物的化学式。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com