
【题目】下列物质常温下呈液态的是 ( )
A.甲烷B.乙烯C.乙炔D.苯
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+ H2O2+ BaCl2= BaSO4↓+ 2HC1 ,用NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 0.1 molBaCl2中所含离子总数约为0.3 NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17gH2O2中所含电子总数约为9 NA
D. 生成2.33gBaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.153 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、 | +7、 | +5、 | ﹣2 |
回答下列问题:
(1)写出它们的元素名称:①②③④⑤⑥⑦⑧
(2)⑧在元素周期表中的位置是(周期、族)
(3)8个元素的最高价氧化物的水化物中,酸性最强的是(填化学式).
(4)①元素和⑥元素形成化合物的电子式是 .
(5)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式: .
(6)下列叙述正确的是(填字母). A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象.请帮助该同学整理并完成实验报告.
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
(1)实验目的:研究同周期元素性质递变规律.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
实验内容 | ① | ② | ③ | ④ |
实验现象(填A~D) |
(3)写出实验①和④对应化学方程式 实验① ,
实验④ .
(4)实验结论: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO![]() 、Cl-、SO42-
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO![]()
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、Na+中的一种或几种,取100mL该溶液,向其中不断滴加NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示, 则下列叙述不正确的是
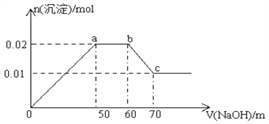
A. 该溶液中一定不含Fe3+、Cu2+
B. 该溶液中一定含有Mg2+、Al3+、NH4+,且三者物质的量浓度之比为1∶1∶1
C. 所加NaOH溶液物质的量浓度为1mol/L
D. a点到b点,没有发生化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com