
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ·mol﹣1
B.C2H2(g)+ O2(g)═2CO2(g)+H2O(l)△H=+2b kJ·mol﹣1
O2(g)═2CO2(g)+H2O(l)△H=+2b kJ·mol﹣1
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ·mol﹣1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ·mol﹣1
科目:高中化学 来源:2016-2017学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
已知常温、常压下,饱和CO2溶液的pH为3.9,用标准浓度的盐酸来滴定锥形瓶中放置时间较长的氢氧化钠溶液,应选用的指示剂及滴定终点颜色变化的情况最好是( )
A.石蕊,由蓝变红 B.酚酞,红色褪去
C.甲基橙,由黄变橙 D.甲基橙,由橙变黄
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是( )
A. B.
B.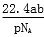 C.
C. D.
D.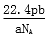
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市、永年二中高二上期中化学卷(解析版) 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)+H2O(g) H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市、永年二中高二上期中化学卷(解析版) 题型:选择题
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi  LixV2O5。下列说法合理的是( )
LixV2O5。下列说法合理的是( )
A. 电池在放电时,Li+向负极移动
B. 锂在放电时作正极, 充电时作阳极
充电时作阳极
C. 该电池充电时阳极的反应为LixV2O5 - xe-=V2O5 + xLi+
D. V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市、永年二中高二上期中化学卷(解析版) 题型:选择题
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ·mol﹣1,下列说法中正确的是( )
A.该反应中熵变、焓变皆 大于0
大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
在相同温度时,100mL0.01mol·L-1的醋酸溶液和与10mL 0.1mol•L-1的醋酸溶液相比较,下列数据中,前者大于后者的是
A.H+的物质的量 B.醋酸电离常数
C.中和时所需氢氧化钠溶液的量 D.醋酸的物质的量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
氢气燃烧的热化学方程式,可用下列两种方程式表示:
①2H2(g)+O2(g)=2H2O(l)+Q1kJ
②H2(g)+1/2O2(g)=H2O(g)+Q2kJ
Q1与Q2的关系为
A .Q1= Q2 B.Q2 >Q1 C.Q1>2Q2 D.Q1<2Q2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.加入反应物,使活化分子百分数增加,化学反应速率增大
D.使用催化剂,降低了反应的活化能、反应速率加快,但是活化分子百分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com