
【题目】Ⅰ.按要求书写下列化学方程式和名称:
(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成_________
(2)甲苯制备TNT_______,用系统命名给TNT命名________
(3)写出2-丙醇的消去反应化学方程式_________
Ⅱ.(1)某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有一个碳碳双键,与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则此烯烃可能的结构简式是:_____(任写一种)。
(2)核磁共振谱表明A分子中只有一种类型的氢。
①用系统命名法给A命名:_________。
②A中的碳原子是否都处于同一平面?________(填“是”或者“不是”)。
【答案】CH2=CH-CH=CH2+Br2![]() CH2Br-CH=CH-CH2Br
CH2Br-CH=CH-CH2Br  2,4,6-三硝基甲苯 CH3-CH(OH)-CH3
2,4,6-三硝基甲苯 CH3-CH(OH)-CH3![]() CH2=CH-CH3+H2O (CH3)2C=C(CH3)2或CH2=C(CH3)CH(CH3)2 2,3-二甲基-2-丁烯 是
CH2=CH-CH3+H2O (CH3)2C=C(CH3)2或CH2=C(CH3)CH(CH3)2 2,3-二甲基-2-丁烯 是
【解析】
I.(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成的位置在第1、4个碳原子上,2,3位置形成碳碳双键;
(2)TNT为2,4,6-三硝基甲苯,由甲苯与浓硝酸在浓硫酸的作用下产生;
(3)2-丙醇在浓硫酸及加热条件下发生消去反应生成丙烯和水;
II. (1)某烃A与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则烃A含有6个碳原子,其相对分子质量为84,则分子式为C6H12,分子中含有一个碳碳双键,发生加成反应时,不影响碳链结构,则双键可能出现在相邻碳原子上均有1个氢原子的位置;
(2)①核磁共振谱表明A分子中只有一种类型的氢,则12个氢原子完全等效,则A为![]() ;
;
②A中甲基所在的位置相当于乙烯中氢原子的位置,所有碳原子共平面;
I.(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成的位置在第1、4个碳原子上,2,3位置形成碳碳双键,反应的方程式为:CH2=CH-CH=CH2+Br2![]() CH2Br-CH=CH-CH2Br;
CH2Br-CH=CH-CH2Br;
(2)TNT为2,4,6-三硝基甲苯,由甲苯与浓硝酸在浓硫酸的作用下产生,方程式为: ;
;
(3)2-丙醇在浓硫酸及加热条件下发生消去反应生成丙烯和水,反应的化学方程式为:CH3-CH(OH)-CH3![]() CH2=CH-CH3+H2O;
CH2=CH-CH3+H2O;
II. (1)某烃A与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则烃A含有6个碳原子,其相对分子质量为84,则分子式为C6H12,分子中含有一个碳碳双键,发生加成反应时,不影响碳链结构,则双键可能出现在相邻碳原子上均有1个氢原子的位置,答案为:![]() 或CH2=C(CH3)CH(CH3)2;
或CH2=C(CH3)CH(CH3)2;
(2)①核磁共振谱表明A分子中只有一种类型的氢,则12个氢原子完全等效,则A为![]() ,根据系统命名法,其名称为2,3-二甲基-2-丁烯;
,根据系统命名法,其名称为2,3-二甲基-2-丁烯;
②A中甲基所在的位置相当于乙烯中氢原子的位置,所有碳原子共平面;


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】根据如图所示装置回答以下问题。

(1)利用如图装置可以验证元素非金属性的变化规律。图中D装置的名称是__,其作用是___。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2、Na2SO3、Na2CO3、H2O2、H2SO4,请选择合适药品设计实验验证氯的非金属性强于硫:装置B中发生反应的化学方程式为:__,装置C中发生的离子方程式为:__。
(3)若要用此装置证明非金属性:S>C>Si,从以下所给物质中选择药品设计实验:①稀盐酸②稀H2SO4③CaCO3④Na2CO3⑤Na2SiO3溶液⑥SiO2。试剂B与C分别为___(填序号);装置C中发生反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 可简写为
可简写为![]() 。现有某化合物W的分子结构可表示为:
。现有某化合物W的分子结构可表示为:![]() 。
。
(1)W的分子式为___________;
(2)W的一氯代物有______种。
(3)下列有关W的说法不正确的是_______(填编号)。
a. 能发生还原反应 b. 能发生氧化反应 c. 能发生加聚反应
d. 等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(4)写出W的芳香族同分异构体(能发生聚合反应)的结构简式________,该聚合反应的化学方程式为__________________________________________________。
(5)W属于_____(填编号)。
a. 芳香烃 b. 环烃 c. 不饱和烃 d. 炔烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数,下列说法正确的是
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 原子序数依次增大,Y 与 W 同族。X、Y、Z 三种原子最外层电子数的关系 为 X+Z=Y。电解 Z 与 W 形成的化合物的水溶液,产生 W 元素的气体单质,此气体同冷烧碱溶液作 用,可得到化合物 ZWX 的溶液。下列说法正确的是
A.W 的氢化物稳定性强于 Y 的氢化物
B.Z与其他三种元素分别形成的化合物中只含有离子键
C.Z 与 Y 形成的化合物的水溶液呈碱性
D.对应的简单离子半径大小为 W >Z > X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“”分别表示出配位键和氢键。_____
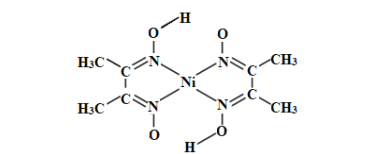
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

①LaNix合金中x的值为_____;
②晶胞中和“![]() ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“![]() ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023,![]() =1.7)
=1.7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,利用NH3催化氧化并释放出电能(氧化产物为无污染性气体),其工作原理示意图如下。下列说法正确的是
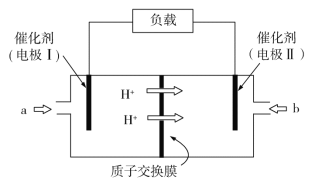
A.电极Ⅰ为正极,电极上发生的是氧化反应
B.电极Ⅰ的电极反应式为2NH36e![]() N2+6H+
N2+6H+
C.电子通过外电路由电极Ⅱ流向电极Ⅰ
D.当外接电路中转移4 mol e时,消耗的O2为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO)=0.075mol/(L·min1)
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com