
下列离子方程式不正确的是
A.FeCl3溶液腐蚀铜印刷电路板:2Fe3++Cu=2Fe2++Cu2+
B.硫酸铝溶液中加入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O
C.浓NaOH溶液处理少量二氧化硫:SO2+ OH-=== HSO3-
D.盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-=SiO32-+H2O
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:选择题
下列热化学方程式书写及括号中的判断正确的是
A.C(s)+1/2O2(g)=CO(g) △H=-110.5 kJ/mol(燃烧热)
B.2H2O(g)=2H2(g)+O2(g) △H=+483.6 kJ/mol(反应热)
C.C2H5OH+3O2=2CO2+3H2O △H=-1368.8 kJ/mol(反应热)
D.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.6kJ/mol(中和热)
查看答案和解析>>
科目:高中化学 来源:2017届北京市丰台区高三上学期期末化学试卷(解析版) 题型:实验题
石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的线路如下:

已知: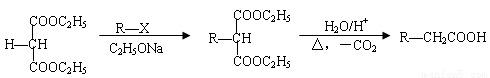
(1)A的顺式异构体的结构简式为_________。
(2)用系统命名法给B命名,其名称是_________。
(3)C含有的官能团名称是_________。
(4)K的结构简式为_________。
(5)依次写出①、②的反应类型_________、_________。
(6)写出下列反应的化学方程式:
D→E:____________________;F→G:___________________。
(7)F还能与其他醇类发生反应,写出F与乙二醇发生聚合反应的化学方程式_________________。
(8)写出同时满足下列条件的医药中间体K的同分异构体的结构简式_____________。
a.与E互为同系物b.核磁共振氢谱有3种峰
(9)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:实验题
氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。

请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达) 。
(2)吸收剂X的化学式为 ,氧化剂Y的化学式为 。
(3)碱性条件下反应①的离子方程式为 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因 。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗。其制备过程如图所示、下列叙述不合理的是
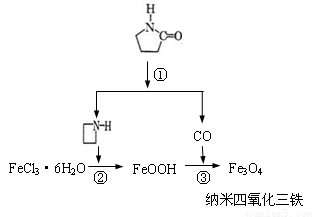
A.在反应②中,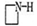 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B.反应③的化学方程式是:6FeOOH + CO ==2Fe3O4+3H2O+CO2
C.直接加热FeCl3溶液也可以得到四氧化三铁
D.纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
化学与人类生产、生活密切相关,下列说法不正确的是
A.计算机芯片的主要材料是Si
B.明矾能使海水淡化从而解决淡水危机
C.可用碘酒灭菌消毒是因为它能使蛋白质变性
D.钠、锶、钡等金属化合物可在燃放时呈现艳丽色彩
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:选择题
常温下,向10mL 0.1mol·L-1HR溶液中逐滴滴入0.1mol·L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图。下列说法不正确的是( )
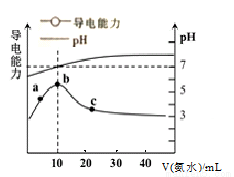
A.常温下,电离平衡常数Ka(HR)≈Kb(NH3·H2O)
B.b点溶液pH=7,此时HR溶液与氨水恰好完全反应
C.c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D.a、b、c三点中,c点NH3·H2O的电离程度最大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:实验题
实验室用98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的H2SO4溶液450mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D )→( A )→( )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度。所配溶液浓度会 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
在密闭容器中进行反应X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z为0.2 mol·L-1 B.Y2为0.35 mol·L-1
C.X2为0.3 mol·L-1 D.Z为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com