
����Ŀ���Թ�����Ϊ�����������������V2O5���ǽӴ�����������Ĵ������ӷϷ������л���V2O5�ȱ�����Ⱦ��������������Դ�ۺ����á��Ϸ���������Ҫ�ɷ�Ϊ:
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.22.9 | 2.83.1 | 2228 | 6065 | 1��2 | <1 |
������һ�ַϷ��������չ���·�ߣ�
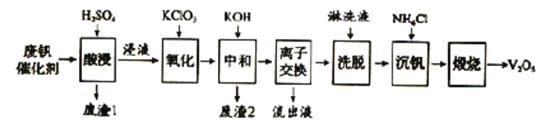
��1�� �������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪ ��ͬʱV2O4ת��VO2+,������1������Ҫ�ɷ��� ��
��2��������������ʹ3 mol��VO2+��ΪVO2+������Ҫ������KClO3����Ϊ mol��
��3�����к�������֮һ��ʹ����V4O124-��ʽ��������Һ�С�������2���к��� ��
��4�������ӽ���������ϴ�����ɼ�ʾΪ��4R0H+ V40124-![]() R4V4O12+4OH-����ROHΪǿ���������ӽ�����֬����Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó� �� ��������������������������������Һ���������������� ��
R4V4O12+4OH-����ROHΪǿ���������ӽ�����֬����Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó� �� ��������������������������������Һ���������������� ��
��5�����������õ�ƫ����泥�NH4VO3��������д�����������з�����Ӧ�Ļ�ѧ����ʽ ��
���𰸡���1��V2O5��2H��=2VO2����H2O ��SiO2
��2��0.5��3��Fe��OH��3��Al��OH��3��4���� ��K��
��5��2NH4VO3![]() V2O5��H2O��2NH3����2�֣�
V2O5��H2O��2NH3����2�֣�
������������������ӷϷ������л���V2O5�������̿�֪���������ʱV2O5ת��ΪVO2+��V2O4ת��VO2+������������������ת��Ϊ���������ӣ�ֻ��SiO2���ܣ�����˵õ�������1ΪSiO2��Ȼ���������KClO3����VO2+��ΪVO2+���ټ�KOHʱ�������ӡ�������ת��ΪFe��OH��3��Al��OH��3������ͬʱ�к����ᣬ���˵õ�������2ΪFe��OH��3��Al��OH��3�������ӽ���������ϴ�����ɼ�ʾΪ��4ROH+V4O124-![]() R4V4O12+4OH-����ROHΪǿ���������ӽ�����֬��֪���������������÷�Ӧ�����ƶ�������Һ����ҪΪ����أ����������õ�ƫ����泥�NH4VO3����������������ʱ�ֽ�����V2O5��
R4V4O12+4OH-����ROHΪǿ���������ӽ�����֬��֪���������������÷�Ӧ�����ƶ�������Һ����ҪΪ����أ����������õ�ƫ����泥�NH4VO3����������������ʱ�ֽ�����V2O5��
��1���������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪV2O5��2H��=2VO2����H2O��������������֪����1ΪSiO2��
��2��������������ʹ3 mol��VO2+��ΪVO2+���ɵ����غ��֪������Ҫ������KClO3����Ϊ3mol����54��/[5��1��]=0.5mol��
��3������������������֪����2ΪFe��OH��3��Al��OH��3��
��4������ǿ���������ӽ�����֬�������ӽ���������ϴ��������Ӧѡ�����������ʹ�ã���OH-Ũ�ȴ�Ӧ�����ƶ����ϴ��Ч�ʣ�������������֪������Һ����ҪΪ����أ���������Һ����������������K+��
��6�����������з�����Ӧ�Ļ�ѧ����ʽΪ2NH4VO3![]() V2O5��H2O��2NH3����
V2O5��H2O��2NH3����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����������Ź㷺��Ӧ�ã����ж�Ӧ��ϵ��������
��ѧ���� | ʵ��Ӧ�� | |
A. | Al2(SO4)3��С�մ�Ӧ | ��ĭ�������� |
B. | ����ͭ������ǿ | FeCl3��ʴCu����ӡˢ��·�� |
C. | �������ξ��������� | Ư��Ư��֯�� |
D. | HF��SiO2��Ӧ | ������ڲ��������Ͽ�ʴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���������NaCl��Һһ��ʱ�����ʹ��Һǡ�ûָ������ǰ������ɼ���������ǣ� ��
A.NaCl
B.H2O
C.����
D.HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ռ���һ�ֺϽ��������̽��(��֪ͭԪ�ص���ɫ��Ӧ����ɫ)��
(1)��۰���ɫ����Ƥ�⻬��
(2)�ھƾ������������գ��������ɫ���Ͻ�Ƭ�ۻ����������䣻
(3)ȡ��ȥ��Ƥ�ĺϽ�10 g������������ϡ�����У��ռ�����״���µ�H2 8.96 L��
(4)��ȡ��ȥ��Ƥ�ĺϽ�10 g������������NaOH��Һ�У�Ҳ�ռ�����״���µ�H2 8.96 L��
�Ծݴ��жϣ��úϽ���һ�����е�Ԫ����________(дԪ�ط���)�����ܺ��е�Ԫ����________(��ѡ����)��
a��Ag b��Mg
c��Na d��Fe
����úϽ���ֻ��2��Ԫ�أ�����ߵ���������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ��װ��Ʒ����Ҫ�ɷ֣�������ͼת����ϵ���ش��������⡣
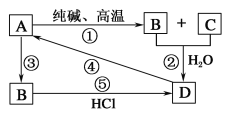
(1)A��;��_____________(��дһ��)��B��_____________��D��_____________��
(2)д����ѧ����ʽ��
��______________________________��
��______________________________��
(3)д�����ӷ���ʽ��
��______________________________��
��______________________________��
��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ����������ȷ���ǣ� ��

A���ױ�ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ483.6Kjmol��1
B���ұ�ʾ���º��������·����Ŀ��淴Ӧ2NO2![]() N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
C������ʾA��B�����ʵ��ܽ�����¶ȱ仯�������A��B������Һ�ֱ���t1��������t2��ʱ�����ʵ���������B��A
D������ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����ͬŨ�ȵ�NaA��Һ��pHС��NaB��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��Һ�еĸ���������Ϊ����������ԭ��Ӧ�����������������
A��Na+��Ba2+��Cl��SO42-
B��Ca2+��HCO3��C1��K+
C��MnO4��K+��I��H+
D��H+ ��Cl ��Na+ ��CO32
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ���������������Dz���ȱ�ٵ�ԭ�ϣ���ҵ������þ���ǽ�þ��������������ȴ�����������У���������ȴþ�������ǣ� ��
A������ B��������̼ C������ D�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧװ�ù���ʱ�����е缫�Ϸ����ķ�Ӧһ����������Ӧ���ǣ�������
A.����
B.����
C.ͭ�缫
D.ʯī�缫
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com