
下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl—)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<②
D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷(解析版) 题型:填空题
CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2·6H2O的工艺流程如下:
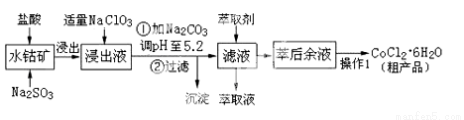
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式_______________________;
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________。
(3) “操作1”中包含3个基本实验操作,它们依次是_______________、________________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为 。
(5)萃取剂的作用是 。
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上12月月考化学试卷(解析版) 题型:选择题
有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmolH2SO4、ymolAgNO3。据此得知原混合溶液中的c(Na+)/mol/L为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:选择题
如图所示实验,如x轴表示流入阴极的电子的物质的量,则y轴可表示

①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①②⑤ B.③④ C.①②④ D.①③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第三次段考化学试卷(解析版) 题型:填空题
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。

接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:

(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第三次段考化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容容器中发生可逆反应:
X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热46.3 kJ |
② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应平衡时XY3的平衡浓度相同
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:填空题
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号)。
A.v(C)=2v(B)
B.容器内压强保持不变
C.v逆(A)=2v正(B)
D.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= 。
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”)。
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a 变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:填空题
在一固定容积的密闭容器中,保持一定条件进行以下反应:X(g)+2Y(g)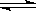 3Z(g),已知加2molX和3molY达到平衡后,生成amolZ。
3Z(g),已知加2molX和3molY达到平衡后,生成amolZ。
(1)在相同实验条件下,若在同一容器中改为加入4molX和6molY,达到平衡后,Z的物质的量为 mol。
(2)在相同实验条件下,若在同一容器中改为加入3molX和2molY,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加 molY, mol Z,才能使平衡时Z为0.6amol。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
B | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检测SO42- |
C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol·L-1的Ca(OH)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com