
| ||
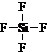 ,
,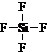 ;
;

科目:高中化学 来源: 题型:
| A、氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B、常温常压下,18g D2O含有6.02×1024个电子 |
| C、标准状况下,11.2L SO3所含3.01×1023个分子 |
| D、离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONH4的电离方程式为:CH3COONH4═CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O═S2-+H3O+ | ||||
| C、次氯酸的结构式为:H-O-Cl | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| O3 |
| H2O |
| O3 |
| H2O |
| O3 |
| H2O |
| 催化剂 |
 ;则机理b是
;则机理b是
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
 b.
b. c.
c.
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题:
氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、维勒打破了无机物和有机物的界限,汤姆生提出了带核的原子结构模型 |
| B、甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C、“光化学烟雾”、“臭氧层空洞”、“温室效应”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
| D、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小有磁性,这种碳与金刚石的关系是同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com